|
Chlor-Alkali-Elektrolyse

 Allgemein
Allgemein
Elektrolyse
(Zerlegung durch elektrische Energie) wässrige Lösung von Kochsalz dient
zur Technischen Gewinnung von Chlor, Natronlauge und Wasserstoff.
-
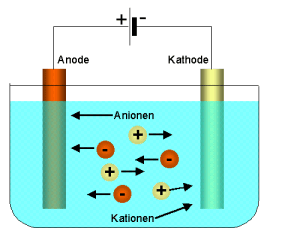
Normalpotentiale von Natrium (-2,7V), Wasserstoff (-0,4V), Chlor
(+1,4V) und Sauerstoff (+0,8V) bei Natriumchloridlösung bei einer
Konzentration von c=1mol/l
=> Das Abscheidungspotential für
Wasserstoff ist geringer als das für
Natrium und das für Sauerstoff geringer
als das für Chlor.
=> An dem (-)Pol entsteht
gasförmiger Wasserstoff (es werden Protonen durch
Elektronenaufnahme zu Wasserstoff reduziert); an dem (+)Pol entsteht
Sauerstoff
(durch
Oxidation aus Hydroxidionen und unter Bildung von Wasser).
=> Durch das Elektrodenmaterial
entsteht eine hohe Überspannung bei Sauerstoff und
eine
geringe bei Chlor
=> Das Abscheidungspotential von Sauerstoff ist folglich
größer als das von Chlor.
Es wird
dabei Graphit als (+)Pol und billiges Eisen als (-)Pol verwendet.
-
Am
(+)Pol wird Chlorid zu Chlor oxidiert und am (-)Pol werden Protonen
zu Wasserstoff reduziert
=> Es ergibt sich eine
Lösung welche unentladenen Natrium- und Hydroxidionen enthält
-
Gefahr: Beim Vermischen von Chlor mit Wasserstoff
=> Chlorknallgasexplosion
-
Verhinderung: Raum des (-)Pols vom Raum des (+)Pols durch ein
Diaphragma-/Amalgamverfahren trennen. Dafür muss der Ausgangsstoff
Natriumchlorid sorgfältig von Magnesium und Calcium gereinigt werden
(diese bilden sonst schwerlösliche Hydroxide, die das Diaphragma
oder den Amalgamzersetzer verstopfen). Außerdem muss Sulfat
sorgfältig entfernt werden, weil dieses die Sauerstoff-Überspannung
am (+)Pol herabsetzt und dort Hydroxidionen frei setzt um mit dem
Graphit des (+)Pols gasförmiges Kohlendioxid zu bilden.
=> Somit würde ein Verschluss des (+)Pols folgen
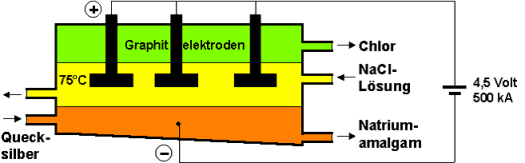
 Amalgam-Verfahren (Quecksilber-Verfahren):
Amalgam-Verfahren (Quecksilber-Verfahren):
(-)Pol: Reduktion
2Na + 2e
 2Na
(mit Hg 2Na
(mit Hg
 NaHg) NaHg)
Folgereaktion: 2Na + 2H O
 2Na
+ 2OH +H(+) 2Na
+ 2OH +H(+) |
(+)Pol: Oxidation
2Cl
 Cl
+2e Cl
+2e
|
Redoxreaktion: 2Na + 2Cl +2H O
 2Na
+ 2OH +2H +2Cl 2Na
+ 2OH +2H +2Cl |
-
Moderne
Großanlagen haben Zellengrößen von ca. 35m², Stromstärken bis zu
450000A und Stromdichten von 10-15kA/m² (bis zu 65 Zellen
erforderlich).
Die Elektrolyse findet bei 70°C in Stahlwannen
statt.
-
Vorteile: Natronlauge wird getrennt von Natriumchloridlösung
erzeugt.
=> sehr reine und hoch konzentrierte Lauge
-
Nachteile: Quecksilber und Quecksilberverbindungen werden
zwangsläufig bei dem Abfluss aus der Amalgamerzeugungszelle
mitgeführt. Weil diese sehr giftig sind und ein Umweltrisiko
darstellen, werden sie unter hohem Kostenaufwand aus den
Elektrolytabwässern entfernt. Aufwändige Reinigungsmaßnahmen der
Elektrolyseanlagen sind notwendig.
=> Das Amalgamverfahren verliert dadurch immer mehr an
Bedeutung.
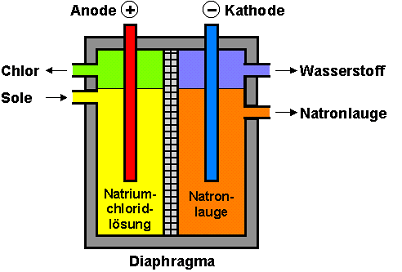
 Diaphragma-Verfahren:
Diaphragma-Verfahren:
(-)Pol: Reduktion
2H O
 2H
+ 2OH 2H
+ 2OH
2H +2e
 H
H
|
(+) Pol: Oxidation
2NaCl
 2Na
+2Cl 2Na
+2Cl
2Cl
 Cl +2e
Cl +2e
|
2H O
+ 2e
 2OH
+ H 2OH
+ H |
2NaCl
 2Na
+ Cl +2e 2Na
+ Cl +2e |
Redoxreaktion: 2NaCl + 2H O
 2NaOH
+ Cl + H 2NaOH
+ Cl + H |
-
Moderne
Diaphragmazellen haben Stromstärken von bis zu 150000A und
Stromdichten von 2,0-2,74kA/m², bei denen eine Zellspannung von
3,0-4,5V und ein Energieverbrauch von 2590-3250kWh pro Tonne Chlor
erforderlich sind.
-
Vorteile: Reines Chlor entsteht, bei einem Energieaufwand (je kg
Chlor) von etwa 3 kWh. Welches somit um 0,5 kWh/kg unter dem
Energieverbrauch des Amalgamverfahrens liegt. Außerdem können
Hypochlorite und Chlorate hergestellt werden.
-
Nachteile: Die entstehende Natronlauge ist sehr verdünnt und mit
Natriumchlorid verunreinigt. Eine nachfolgende Salzabtrennung und
ein Eindampfen der Natronlauge ist deshalb zusätzlich notwendig.
|