|
Reaktion
Triglycerid + 3 NaOH ->
Glycerin + 3Natriumsalze der Fettsäuren
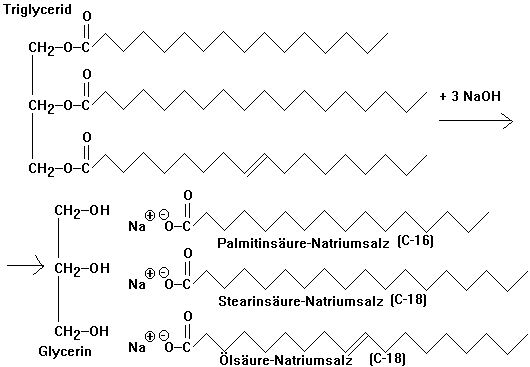
Seifen sind Alkalisalze
langkettiger Fettsäuren
Industrielle
Fettverseifung : Hochdruckverfahren
Hitze,Druck,Kat.
Triglycerid + 3 Wasser
--------------> Glycerin + 3 Fettsäuren
Reinigung der Fettsäuren
durch Destillation im Vakuum zur Qualitätssteigerung: kurzkettige
Fettsäuren werden abgetrennt - auch minderwertige Fette können für
die Seifengewinnung herangezogen werden, nach Fetthydrierung auch
minderwertige Fette
Bau des Seifenanions:
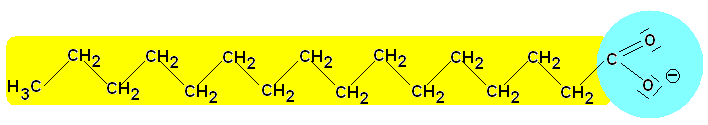
lipophiler
(hydrophober) hydrophiler Bereich
Alkylrest mit Affinität zu
durch Ladung und Polarität
unpolaren Gruppen
der Carboxylat-Gruppe
Versuche:
Tyndall-Effekt einer Seifenlösung (kolloid-disperse Verteilung -
Teilchengröße zwischen 10 und 100 nm
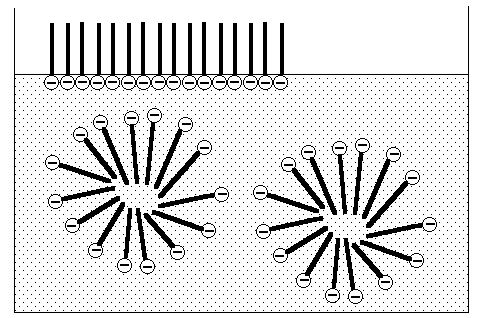
Micellenbildung und
Anordnung der Seifenanionen an Grenzflächen
Versuch: halb
gefüllte Glaswanne mit Kohlepulver bestreuen, anschließend einen
kleinen Tropfen Seifenlösung in die Mitte geben
Skizze: Micellenbildung und
Anordnung der Seifenionen an Grenzflächen:
Die Waschwirkung der Seife
beruht auf
Die Schaumkraft dagegen ist
kein spezifisches Merkmal der Waschkraft.
Versuch: Herabsetzung der
Oberflächenspannung (Projektion)

Deutung: H-Brücken des
Wassers bewirken Oberflächenspannung - Abstoßung der Seifenanionen
und nur schwache Van-der-Waals-Kräfte zwischen den
Kohlenwasserstoff-Resten.
Netzkraft:
Herabsetzung der Oberflächenspannung erleichtert Benetzung
und Eindringen der Waschlauge als Voraussetzung für den
Waschvorgang.
Emulgier- und
Suspendiervermögen: Die waschaktive
Substanz umgibt in monomolekularer Schicht etwa ein Öltröpfchen oder
ein Pigmentkorn.
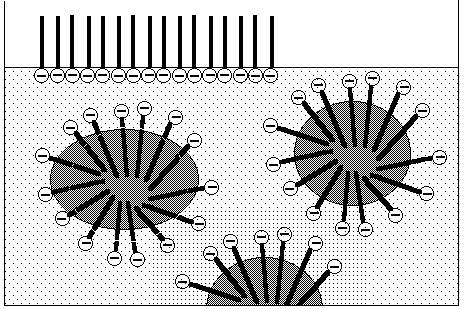
Schmutztragevermögen
Das Wiederaufziehen des
bereits abgelösten Schmutzes wird verhindert.
Nachteile der Seife:
Alkalische Wirkung, Säure- und Härteempfindlichkeit
Vorteile der Seife: leichte
biologische Abbaubarkeit
Nachteile:
Alkalische Reaktion:
Versuch: Prüfung einer
wässrigen Seifenlauge mit pH-Indikator und Phenolphthalein
Ergebnis: Carboxylationen
wirken in wässriger Lösung stark basisch:
R-COO-
+ H2O <=> R-COOH + OH-
Folge: Brennen in den Augen,
Quellung der Haut, Schädigung empfindlicher Textilien
Säureempfindlichkeit
Versuch: Seifenlauge
mit verd. Salzsäure versetzen.
Beobachtung: weißer
Niederschlag
Erklärung: Abscheidung der
freien Fettsäuren:
R-COO-
+ H3O+ -> R-COOH + H2O
Folge: Verlust der
Waschwirkung, Verschmutzung der Wäsche durch die unlöslichen
Fettsäureniederschläge.
Härteempfindlichkeit
Versuch: Seifenlauge
mit hartem Wasser (ersatzweise: Calciumchloridlösung)
Beobachtung: Niederschlag
Erklärung: unlösliche
Kalkseife fällt aus:
2 R-COO-
+ Ca2+ -> (R-COO-)2 Ca2+
Folge: Die Seife verliert in
hartem Wasser einen Teil ihrer Waschwirkung, die ausfallende
Kalkseife lagert sich störend auf der Wäsche ab.
Möglichkeiten, die störenden
Calciumionen zu beseitigen?
Soda (Versuch)
Ableiten der Tensidwirkung aus der
Molekülstruktur; Hinweis auf kationaktive und nicht-ionogene Tenside
Wiederholung: Nachteile der Seife
(Unbeständigkeit in hartem Wasser, Säure- und Alkaliempfindlichkeit)
Detergentien, die nicht die Nachteile der Seife
aufweisen? Veränderung der Seifen-Carboxylgruppe:
Tensidklassen:
 |
Anionische
Tenside
(Aniontenside) |
 |
Kationische
Tenside
(Kationtenside) |
 |
nichtionische Tenside |
 |
amphotere
Tenside
=
zwitterionische Tenside
(Amphotenside) |
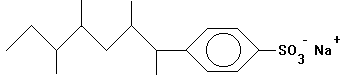
Synthetische Tenside -
Beispiel: Alkylbenzolsulfonate
|
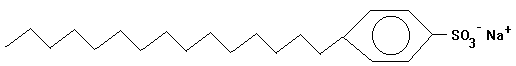
lineares Alkylbenzolsulfonat |
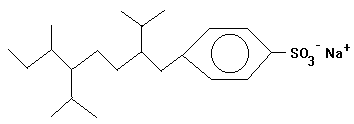
stark verzweigtes Alkylbenzolsulfonat (=> biologisch
schwer abbaubar) |
Aniontensid:
Aufbau analog zur Seife
Überlegung: Welche
nachteiligen Eigenschaften der Seife treten bei
Alkylbenzolsulfonaten nicht auf? (Begründung!)
Synthese eines
Alkylbenzolsulfonats:
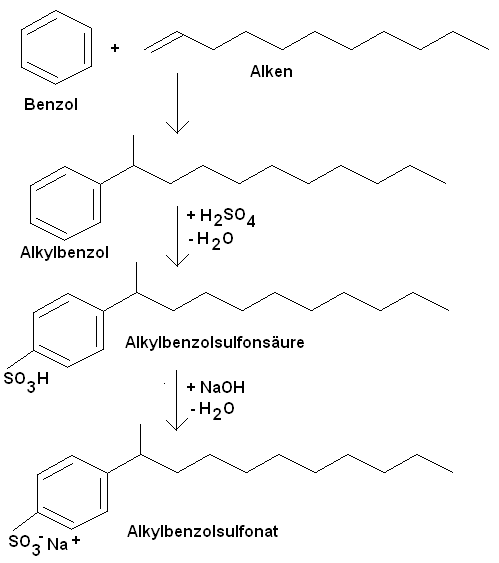
Weitere Tenside
(Beispiele):
Versuch:
Fettalkoholsulfat
1 ml
Dodecanol + 1 ml konz. Schwefelsäure ca. 5 min erwärmen, mit ca. 250
ml Wasser verdünnen, nach Zugabe von wenig Indikator Neutralisation
mit verd. NaOH.
- Schüttelschaum
- Emulgiervermögen prüfen
durch Schütteln mit Öl (angefärbt mit Sudanrot), Vergleichslösung
Öl-Wasser
------C12-C14-------OH
+ HO-SO3H -> -----C12-C14--------O-SO3-Na+
+ H2O
Nichtionische Tenside
Polyglycolether
Die Öl- und Wasserlöslichkeit hängt vom
Größenverhältnis des hydrophoben Teils zum hydrophilen Teil ab -
technische Tenside uneinheitlich - ausgezeichnete Eigenschaften,
wenig Schaum - aus Ethylenoxid
Fettsäure-monoglyceride
und Ester von Fettsäuren mit Zucker als Emulgatoren in der
Lebensmittel- und Kosmetikindustrie
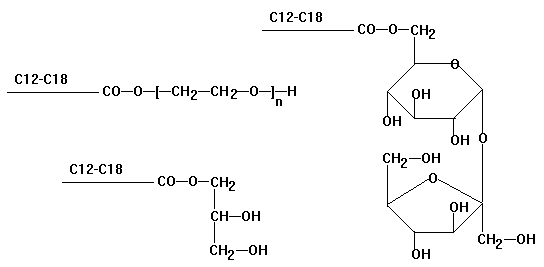
Kationtenside
„Invertseifen“ Tetraalkylammoniumsalze (quartäre
Ammoniumverbindungen):
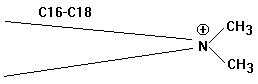
Vorteile:
Ampholyte
enthalten anionische und kationische Gruppe (vergl.
Zwitterionenstruktur der Aminosäuren)
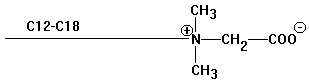
Vorteil: härteunempfindlich
für Haarshampoos und Schaumbäder
/* Waschmittel und Umweltschutz 6h
Tenside
- auch Seife! (wirkt
schaumregulierend)
- biologische Abbaubarkeit
der verzweigtkettigen Alkylbenzolsulfonate zu langsam -
Detergentiengesetz 1961
Komplexbildner
- früher: Soda und Pottasche
- Polyphosphate:
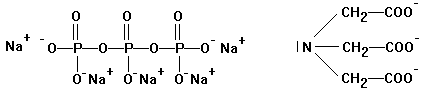
Wegen Eutrophierung
Substitution durch
- Nitriloacetat NTA
- Natriumaluminiumsilicat (Zeolit)
"SASIL
Bleichmittel
z.B. gegen Obst- und
Rotweinflecken
früher: Rasenbleiche,
oxidative Zerstörung von Farbstoffen
- Perborat
spaltet Wasserstoffperoxid
ab:
NaBO2.H2O2.3H2O
----------> NaBO2 + H2O2 + 3 H2O
Versuch:
Sauerstoffabspaltung durch Wasserstoffperoxid, Bleichwirkung
Stabilisatoren
Verhindern die
unkontrollierte Zersetzung des Perborats durch Komplexierung der
Schwermetallionen "Prinzip der stabilisierten Sauerstoffentbindung"
- Ethylendiamintetraacetat
Vergrauungsinhibitoren
verhindern das erneute
Festsetzen des abgelösten und dispergierten Schmutzes auf der Faser
- Carboxymethylcellulose
CMC, wirksam bei Naturfasern
Für Synthetikfasern mußten
eigene Vergrauungsinhibitoren entwickelt werden "Kampf gegen den
Grauschleier"
Korrosionsinhibitoren
zum Schutz der
Waschmaschinenteile gegen die Waschlauge (z.B. Wasserglas
Schaumregulatoren
früher: "gut geschäumt ist
halb gewaschen" aber: Nachteil in der Waschmaschine
- Behensäure
Optische Aufheller
Versuch!
früher: Wäscheblauung -
Nachteil?
- "Blaustrahler": Umwandlung
von UV in sichtbares Licht "weißer als weiß"
Enzyme
- Proteasen bis 65°C wirksam
(Eiweiß!)
1.1 Entscheide, welche von den angegebenen Verbindungen
Waschwirkung zeigen
(in
Spalte a eintragen; Waschwirkung: „+“; keine Waschwirkung: „-“).
1.2
Entscheide nur für die Fälle, in denen Waschwirkung vorhanden ist,
ob die Verbindung
b)
Säureempfindlichkeit
c)
alkalische Reaktion in wässriger Lösung
d)
Härteempfindlichkeit
aufweist
1.3
Für die Verbindungen, die keine Waschwirkung zeigen, sind die Gründe
dafür anzugeben .
1.4
Wäre es sinnvoll, die in der Tabelle enthaltenen waschaktiven
Substanzen zu einem Waschpulver zusammen zu mischen? (mit
Begründung!)
|