pH Wert, Säuren und Basen
Erfahre mehr zum Thema pH Wert, Säuren und Basen und dem Ionenprodukt
Der pH Wert
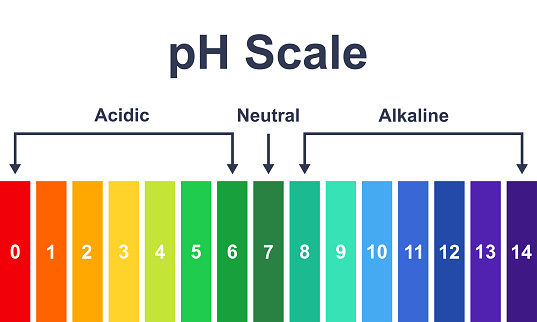
Der pH-Wert ist eine Messgröße, die angibt, ob eine Lösung sauer, neutral oder basisch ist. Der pH-Wert wird auf einer Skala von 0 bis 14 gemessen, wobei 7 neutral ist. Ein pH-Wert von weniger als 7 zeigt an, dass eine Lösung sauer ist, während ein pH-Wert von mehr als 7 anzeigt, dass sie basisch ist. Je niedriger der pH-Wert ist, desto saurer ist die Lösung. Je höher der pH-Wert ist, desto basischer ist die Lösung.
Der pH-Wert hängt von der Konzentration der Wasserstoffionen (H+) und Hydroxidionen (OH-) in einer Lösung ab. In einer sauren Lösung gibt es mehr H+-Ionen als OH--Ionen, während in einer basischen Lösung mehr OH--Ionen als H+-Ionen vorhanden sind. In einer neutralen Lösung sind H+- und OH--Ionen in gleicher Konzentration vorhanden, was zu einem pH-Wert von 7 führt.
In der Chemie und Biologie ist es wichtig, den pH-Wert von Lösungen zu messen, um die richtigen Bedingungen für chemische Reaktionen oder biologische Prozesse zu schaffen. Zum Beispiel sind viele Enzyme, die in unserem Körper arbeiten, empfindlich auf den pH-Wert und funktionieren nur innerhalb eines bestimmten pH-Bereichs. Aber auch in der Industrie ist der pH Wert wichtig zur Herstellung und Verarbeitung von Produkten.
Der pH-Wert kann durch pH-Indikatoren oder pH-Messgeräte gemessen werden.
Säuren und Basen

Säuren und Basen sind zwei Arten von chemischen Substanzen, die sich durch ihre Eigenschaften und Reaktionen mit anderen Substanzen unterscheiden.
Säuren sind Substanzen, die in Wasser gelöst Wasserstoffionen (H+) freisetzen. Sie haben einen pH-Wert von weniger als 7 auf der pH-Skala und schmecken sauer. Beispiele für Säuren sind Essigsäure (in Essig), Salzsäure (in Magensäure) und Zitronensäure (in Zitrusfrüchten). Säuren können auch in der Lage sein, Metalle zu korrodieren und Reizungen der Haut oder der Schleimhäute zu verursachen.
Basen hingegen sind Substanzen, die in Wasser gelöst Hydroxidionen (OH-) freisetzen. Basen haben einen pH-Wert von mehr als 7 auf der pH-Skala und schmecken bitter oder seifig. Beispiele für Basen sind Natriumhydroxid (Lauge) und Calciumhydroxid (Kalkmilch). Basen können auch in der Lage sein, Säuren zu neutralisieren und sind in vielen Reinigungsmitteln und Haushaltsprodukten enthalten.
Säuren und Basen können miteinander reagieren. Das führt dann zu einer Neutralisation. Bei der Neutralisation reagieren die H+-Ionen der Säure mit den OH--Ionen der Base und es bildet sich Wasser und ein Salz. Wenn zum Beispiel Salzsäure und Natriumhydroxid miteinander reagieren, entsteht Wasser und das Salz Natriumchlorid (Kochsalz).
Konzentrierte Säuren und Basen können können schwere Verätzungen hervorrufen. Deshalb sollte mit ihnen nur unter dem Abzug oder mit Schutzbrille gearbeitet werden.
Das Ionenprodukt

Das Ionenprodukt bezieht sich auf die Konzentration von Ionen in einer Lösung. Es wird auch als Ionengleichgewichtsprodukt oder Löslichkeitsprodukt bezeichnet.
Das Ionenprodukt ist besonders wichtig, um die Löslichkeit von Salzen in Wasser zu verstehen. Wenn Salze in Wasser gelöst werden, werden sie in ihre Ionen, aufgeteilt. Zum Beispiel wird Natriumchlorid (NaCl) in Wasser gelöst in Natriumionen (Na+) und Chloridionen (Cl-) aufgeteilt. Die Konzentrationen dieser Ionen können durch das Ionenprodukt berechnet werden. Das Ionenprodukt wird durch Multiplikation der Konzentrationen der Ionen in der Lösung berechnet. Für Natriumchlorid wäre das Ionenprodukt das Produkt der Konzentrationen von Natriumionen und Chloridionen:
Ionenprodukt = [Na+] x [Cl-]
Das Ionenprodukt ist eine wichtige Größe, da es bestimmt, ob ein Salz in einer bestimmten Konzentration in Wasser gelöst werden kann oder nicht. Wenn das Ionenprodukt kleiner als die Löslichkeit des Salzes ist, wird sich das Salz in der Lösung lösen und als gelöste Ionen vorliegen. Wenn das Ionenprodukt größer als die Löslichkeit des Salzes ist, wird sich das Salz nicht vollständig in der Lösung auflösen und es wird eine unlösliche Verbindung bilden, die als Niederschlag bezeichnet wird.
Das Ionenprodukt gibt an wann eine Lösung gesättigt ist.

