Kunststoffe
Kunststoffe: Einführung
Einführung: Kunststoffe als
makromolekulare Werkstoffe
Kunststoffe:
-
sind in ihren wesentlichen Bestandteilen organischer
Natur
-
werden aus Makromolekülen aufgebaut (>10000u)
-
entstehen durch Synthese oder
durch Umwandlung von Naturprodukten
Versuche: Nachweis der
organischen Natur durch Verkohlen oder Erhitzen eines Kunststoffpulvers mit
Kupfer(II)-oxid und Nachweis des Kohlenstoffdioxids mit Kalkwasser.
Hinweis auf den makromolekularen
Charakter: Viskosität einer Kunststofflösung
historische Entwicklung
Staudinger postulierte 1920
die Existenz von Makromolekülen (Nobelpreis erst 1953)
erste Kunststoffe:
Gummi
Naturkautschuk bekam erst nach
Entdeckung der Vulkanisation technische Bedeutung (Goodyear
1839)
Galalith
(Kunsthorn) aus mit Lab gefälltem
Casein - Vernetzung mit Methanal
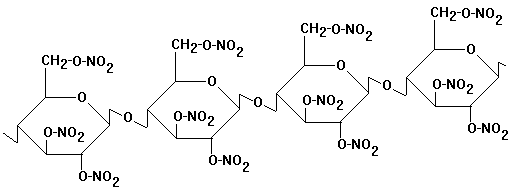
Nitrocellulose - Celluloid
Feuergefährlichkeit! Herstellung
durch Nitrieren von Cellulose (Versuch)
Bakelit
Phenol-Formaldehyd-Kunstharz
(ursprünglich als Elfenbein-Ersatz)
Moderne Kunststoffe
- Demonstrationsmaterial - Erdöl als
Rohstoff
Kunststoffe im Wettbewerb mit
Naturstoffen?
Natürlich vorkommende Makromoleküle
können als Vorbild dienen, wie man künstlich Makromoleküle herstellen kann:
Cellulose, Stärke, Chitin
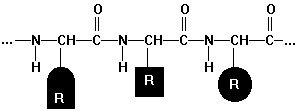
Eiweiß (Wh Peptidbindung)
Niedermolekulare Bausteine (Monomere)
die mindestens zwei reaktionsfähige Gruppen enthalten (oder
mindestens eine reaktionsfähige Doppelbindung) können durch Mehrfachreaktion
zu Makromolekülen (Polymeren) verknüpft werden.
Produkte der Petrochemie als
Ausgangsstoffe
Fraktionierte Destillation
Trennung der Bestandteile des Erdöls
in einer Destillierkolonne nach unterschiedlichem Siedepunkt liefert
-
Gase (Propan, Butan)
-
Leichtbenzin
-
Schwerbenzin
-
Petroleum
-
Heiz- und Dieselöl
-
Paraffin
-
Rückstand: Bitumen
Die mengenmäßige Verteilung der
Produkte entspricht nicht dem Bedarf => Umwandlung notwendig.
Crack-Prozess
Langkettige Kohlenwasserstoffe
werden in kürzere zerlegt.
Thermisches Cracken:
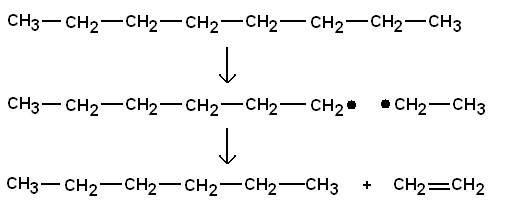
Thermisches Cracken von Benzin
liefert die wichtigen Chemierohstoffe Ethen und Propen
Weitere Verfahren: Katalytisches
Cracken und Hydrocracken
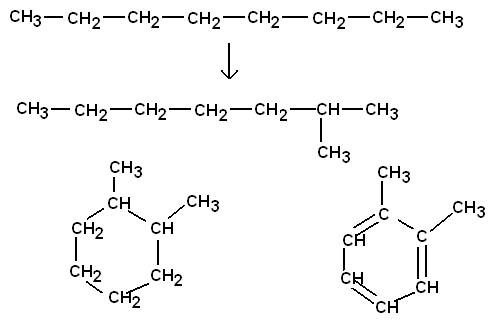
Reformieren
Isomerisierung unter Bildung verzweigtkettiger Alkane und
Cycloalkane sowie
Dehydrierung (Wasserstoff-Abspaltung) unter Bildung von
Aromaten:
Ethen als Ausgangsstoff für organische Synthesen:
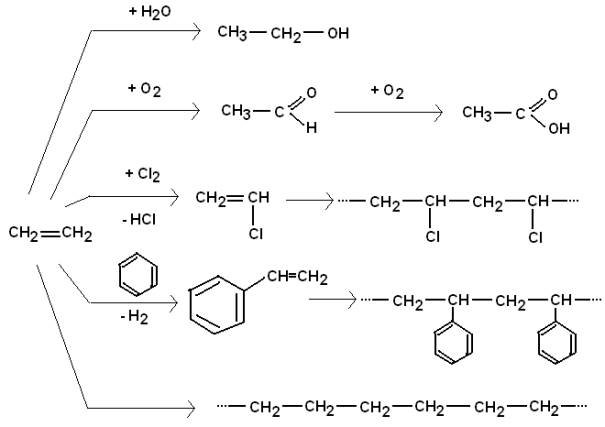
Synthese durch Polyreaktionen
(Polymerisation, Polykondensation, Polyaddition)
Bei der Polymerisation lagern sich ungesättigte
Verbindungen unter Aufrichtung der Doppelbindung zu Makromolekülen zusammen.
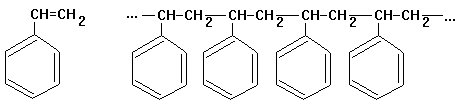
Beispiel: Styrol (Monomer) ->
Polystyrol
Versuch: Depolymerisation von
Polymethylmethacrylat (=Plexiglas) und Nachweis der Doppelbindung
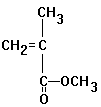
- Bromwasser wird entfärbt
- Braunfärbung von alkalischer
Permanganatlösung
Radikalmechanismus der
Polymerisation
Versuch:
Polymerisation von Styrol
Die Polymerisation der Monomeren
kann durch Radikale ausgelöst werden. Das Radikal verbindet sich mit einem
ungesättigten Molekül, z.B. Styrol, das damit selbst zum Radikal wird.
(Vergleich des Prinzips der freien
Hand mit Tanzpaaren)
1. Startreaktion: Radikalbildung
z.B. organische Peroxide als Starter
Beispiel: Dibenzoylperoxid
C6H5-CO-O-O-CO-C6H5
-> 2 C6H5-CO-O* = R*
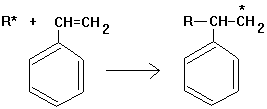
2. Wachstumsreaktion: Das neue
Radikal reagiert mit einem weiteren Styrolmolekül usw. Es entsteht eine
durch Atombindungen zusammengehaltene Kohlenstoffkette:
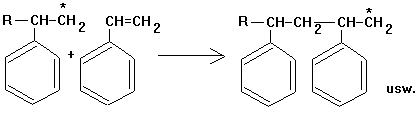
3. Abbruchsreaktionen: Vereinigung
zweier Radikale (Rekombination) oder Bildung von Alkan und Alken durch
Übergang eines Wasserstoffatoms:
R-CH2-CH2*
+ *CH2-CH2-R´ -> R-CH2-CH2-CH2-CH2-R´
R-CH2-CH2*
+ *CH2-CH2-R´ -> R-CH2-CH3 +
CH2=CH-R´
Technisch wichtige Polymere
| Monomere |
Polymere |
|
| Ethen |
Polyethen PE |
|
| Propen |
Polypropen PP |
|
| Styrol |
Polystyrol PS |
|
| Vinylchlorid |
Polyvinylchlorid PVC |
|
| Acrylnitril |
Polyacrylnitril PAN |
|
| Methacrylsäureester |
Polymethacrylsäureester PMMA |
|
| Tetrafluorethen |
Polytetrafluorethen PTFE |
|
Formeln aufstellen!
Polykondensation
Bei der Polykondensation werden Monomere mit
mindestens zwei funktionellen Gruppen unter Austritt eines kleinen Moleküls,
meist Wasser, zu Makromolekülen vereinigt
Beispiele für
Verknüpfungsmöglichkeiten:
Amidbindung und Esterbindung:
Amin Carbonsäure
Amid (Peptid)
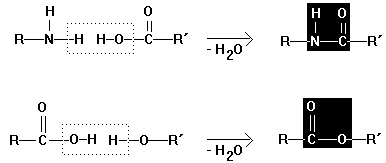
Carbonsäure
Alkohol Ester
Polyamide: Nylon, Perlon
Versuch: Herstellung von
Nylon 6,6 durch Grenzflächenkondensation von Hexandicarbonsäure-dichlorid
mit 1.6-Diamino-hexan:
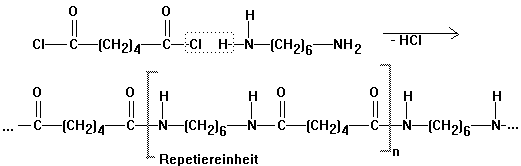
Technische Synthese von Nylon 66 aus
AH-Salz: Adipinsäure + Hexamethylendiamin
Perlon (= Nylon 6) aus H2N-(CH2)5-COOH
über Caprolactam
Kevlar: ...-CO-C6H4-NH-[-CO-C6H4-NH-]n-CO-C6H4-NH-...
aus p-Aminobenzoesäure
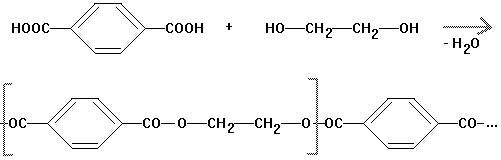
Polyester
Versuch: Herstellung eines
Polyesters aus Glycerin und Benzol-1.2-dicarbonsäure (=Phthalsäure)
Durchführung: Man
gibt in ein Rg 3 g Phthalsäureanhydrid und 3 ml Propantriol. Das Glas wird
nicht ganz lotrecht am Stativ befestigt und etwa 20 min über kleiner Flamme
erhitzt. Ergebnis: Die ursprünglich dünnflüssige Masse wird dickflüssig.
Beim Abkühlen wird sie fest.
-> Glyptal, Lackrohstoff
Fasern: Diolen, Trevira
aus Glycol und
Benzol-1.4-dicarbonsäure (=Terephthalsäure)
ungesättigte Polyester (z.B. für
glasfaserverstärkte Werkstoffe) z.B. aus Maleinsäure + zweiw. Alkohol ->
ungesättigter linearer Polyester - Vernetzung mit Styrol
Phenoplaste und Aminoplaste
Versuch: Synthese eines
Phenolharzes
Resorcin mit der halben
Menge Methanallösung versetzen, 10 Tr. verd. Natronlauge zugeben, mischen,
warten, evtl. leicht erwärmen (Vorsicht!). Es entsteht eine feste, rotbraune
Masse
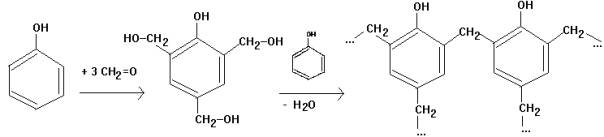
Erklärung: Methanal greift das
Phenol in o- und p-Stellung elektrophil an unter Bildung einer
trifunkionellen Hydroxymethylenverbindung - Verknüpfung der Phenolbausteine
unter Wasserabspaltung unter Bildung von Methylenbrücken - dreidimensionale
Vernetzung -> Duroplast
Bakelit:
Versuch: Synthese eines
Harnstoffharzes
3 cm hoch Harnstoff mit 35%
Methanallösung (=Formalin) bedecken, erwärmen bis zur Lösung des Harnstoffs
- 3 Tr. konz. Salzsäure zugeben (Vorsicht!). Nach kurzer Zeit scheidet sich
Harnstoffharz als feste weiße Masse ab.
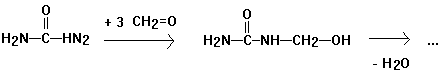
Polycarbonat (z.B. CD) aus Phosgen
und einem Diol (z.B. Bisphenol A)
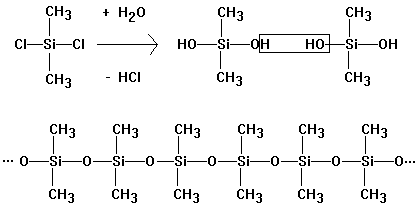
Silicone
Durch
Hydrolyse von Dimethyldichlorsilan (und Methyltrichlorsilan) bildet sich das
entsprechende Silanol, das durch Wasserabspaltung (Polykondensation) Silicon
bildet:
Vorteil
der Silicone:
-
Temperaturbeständigkeit
-
Alterungsbeständigkeit
-
Körperverträglichkeit
Verwendungsmöglichkeiten
-
Schläuche
-
Kosmetika, Implantate
-
Bautenschutzmittel
-
Kabelisolierungen
Polyaddition
Polyaddition: Bildung von Makromolekülen durch
Verknüpfung mehrfunktioneller Monomere ohne Austritt von Wasser, dafür
Wanderung eines Protons bei jedem Reaktionsschritt.
Polyurethane
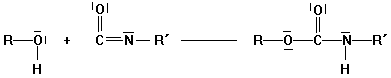
Alkohol Isocyanat Urethan
Addition von mehrfunktionellen
Alkoholen (z.B. Glycol) mit mehrfunktionellen Isocyanaten:
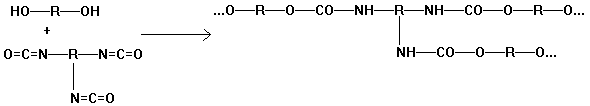
Versuch: Herstellung eines
Polyurethan-Schaumpilzes
Schaumstoff entsteht durch Zusatz
von Wasser zur Alkoholkomponente. Wasser reagiert mit Isocyanat unter
CO2-Entwicklung, dieses Gas bläht den sich bildenden Kunststoff auf:
R-N=C=O + H-O-H -> R-NH2
+ CO2
anderes Beispiel: Polyoxymethylen
durch Polyaddition von Methanal
Struktur und Eigenschaften (Pr):
Thermoplast, Duroplast, Elastomer
Versuche: Verhalten von
Thermoplasten und Duroplasten beim Erhitzen
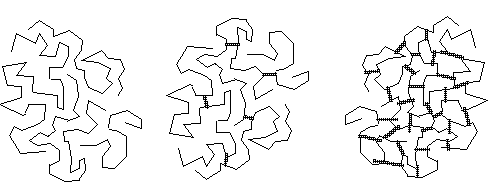
Thermoplaste :werden
beim Erhitzen plastisch und lassen sich verformen
Beispiele:
PE,
PP, PS, PVC
Erklärung:
Zwischen den Molekülfäden wirken nur geringe Kräfte. Die ineinander
verfilzten, aber nicht miteinander verbundenen Molekülfäden können sich
durch Wärmeschwingungen voneinander freimachen. Erwärmt lassen sie sich
daher verformen.
Elaste:
Die Form kehrt nach Dehnung, auch bei hohen Temperaturen, wieder in den
Ausgangszustand zurück.
Beispiele: natürliche und synthetische Gummistoffe
Erklärung: Die Molekülketten sind an einigen Stellen kovalent verknüpft, sie
können sich daher nicht vollständig voneinander lösen, sondern das Knäuel
sucht immer wieder, auch wenn es stark gedehnt worden ist, wieder in der
Ausgangszustand zurückzukehren.
/*
Natur- und Synthesekautschuk
Durch
Vulkanisieren entsteht aus Kautschuk mit vorwiegend plastischen
Eigenschaften ein Gummi mit vorwiegend elastischen Eigenschaften. Dies wird
durch Vernetzung erreicht: Erhitzen mit 3 - 5 % Schwefel -> Bildung von
Brücken (bei höherem Schwefelgehalt entsteht Hartgummi!):
-C-S-S-C- -C-S-C-
Naturkautschuk: 1.4-cis-Polyisopren
Isopren:
CH2=C(CH3)-CH=CH2
/*
Silicone, Siliconkautschuk
Herstellung aus Dimethylsiloxan. Vorteile: Temperaturbeständig bis 200°C,
Alterungsbeständigkeit. Nachteil: etwas geringere Elastizität
...-O-Si(CH3)2-O-Si-O-Si(CH3)2-O-Si-...
(Gerüst: -O-Si-O-Si-)
Duroplaste:
Harte, starre Kunststoffe, die beim Erhitzen weder plastisch noch
flüssig werden.
Beispiel: Phenol-Formaldehyd-Kunstharz
Erklärung: Durch engmaschige Vernetzung über zahlreiche Querverbindungen
geht die Elastizität verloren. Wärmeschwingungen sind weitgehend blockiert.
Der Kunststoff ist nach der vollen Aushärtung nicht mehr verformbar.
Struktur von Thermoplasten
Polyethylen
PE: teilkristallin
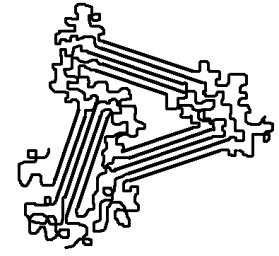
->
milchig durchscheinend
Zwischen kristallinen Bereichen liegen amorphe Abschnitte (teilkristalline
Ordnung). Die kristallinen Bereiche besitzen hohe Festigkeit, die
ungeordneten Elastizität. PE vereinigt daher Festigkeit mit federnder
Elastizität. Der Kunststoff erscheint milchig getrübt, da sich kristalline
und amorphe Bereiche in Dichte und Brechungsindex unterscheiden.
Polystyrol
PS: sperrige Seitenketten
->
große Phenylgruppe behindert die Beweglichkeit der Molekülfäden stark -
daher kaum kristallisiert - PS ist hart und spröde und glasklar - wegen
niedriger Erweichungstemperatur geeignet für Schaumstoffe
Polyvinylchlorid
PVC: Dipolkräfte
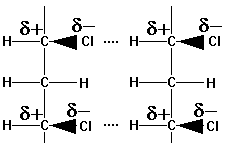
->
zusätzlicher Zusammenhalt - höhere Erweichungstemperatur - Schmelze mit
kautschukartiger Zähigkeit, weil die Ketten zwar in sich beweglich, die
Dipole aber nicht unwirksam werden.
Verhalten zu Lösemitteln: beständig gegenüber unpolaren (Kohlenwasserstoffe)
und stark polaren Lösungsmitteln, dagegen Quellung in Lösungsmitteln mit
mittlerem Dipolcharakter. Prinzip: Ein Stoff kann durch die gleichen Kräfte
getrennt werden, die seinen Zusammenhalt bewirken.
Weichmacher:
PVC wird durch Einbau von Weichmacher-Molekülen gummiartig elastisch.
Weichmacher sind z.B. schwerflüchtige Ester mehrwertiger Säuren (Phthalsäure)
mit langkettigen Alkoholen (Decanol).
Bei
dieser Weichmachung werden die starren Dipol-Dipol-Assoziate getrennt und
durch bewegliche Weichmacher-Dipole wieder verknüpft (Abschirm- und
Scharnier-Effekt).
Weichmacher können leicht herausgelöst werden, daher ist Weich-PVC gegen
Lösungsmittel empfindlich.
Versuch: Entfernen des
Weichmachers aus Weich-PVC
Durchführung: Ein Streifen Weich-PVC wird in mehrfach gewechseltem, heißem
Methanol geschüttelt, dann zwischen Filtrierpapier getrocknet.
Ergebnis: Das mit Methanol behandelte Weich-PVC ist deutlich spröder als ein
unbehandeltes Vergleichsstück.
/* Herstellung von Kunstfasern:
Schmelzspinnverfahren:
Das Polymere wird geschmolzen und unter hohem Druck durch Spinndüsen gepreßt.
Es erstarrt beim Abkühlen zu dünnen Fäden
Naßspinnverfahren:
Dabei wird das Lösungsmittel im Wasser aufgelöst
Versuch: Darstellung von Fäden aus Polyacrylnitril
Durchführung: Man stellt eine etwa 8%ige Spinnlösung her, indem man 0,5 g
Polyacrylnitril in 5 ml Dimethylformamid in einem Rg löst. Diese Lösung
drückt man mit Hilfe einer Injektionsspritze, deren Kanüle nicht zu eng sein
darf, in ein wassergefülltes Gefäß.
Ergebnis: Die Lösung erstarrt beim Verlassen der Kanüle zu einem Faden, der
gefasst und vorsichtig abgezogen wird. Da die Versuchsbedingungen erheblich
von den Vorschriften des technischen Verfahrens abweichen, hat der Faden nur
eine unzureichende Festigkeit. Er läßt sich auch nicht verstrecken.
Trockenspinnverfahren:
Die Lösung wird in einen heißen Gasraum gepresst
Versuch: Verstrecken einer
PE-Folie: Die zuvor wirr durcheinanderliegenden Molekülfäden werden parallel
angeordnet.
Textilveredlung:
Texturieren: Die zuvor glatte Faser wird flauschig gekräuselt
Thermofixieren: Formung bei hoher Temperatur, bleibt beim Abkühlen dauerhaft
erhalten, z.B. Falten
Ionenaustauscher
enthalten an festen Träger gebundene, zum Austausch fähige Gruppen (=
Ankergruppen). An die Stelle der Gegenionen A treten die Gegenionen B.
Nach
Art der Gegenionen unterscheidet man Kationen- und
Anionenaustauscher
stark
sauer: Sulfonsäuregruppe -SO3H
schwach
sauer: phenolische OH-Gruppe
schwach
basisch: Aminogruppe -NH2
stark
basisch: Trialkylamin-Gruppe -NR3+
Vollentsalzung des Wassers durch Hintereinanderschaltung eines Kationen- und
eines Anionenaustauschers -> Kationen werden gegen Protonen, Anionen gegen
Hydroxidionen ausgetauscht, beide vereinigen sich zu Wasser.
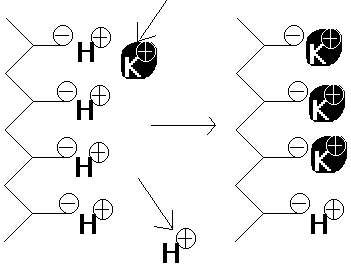
Ist das
Polyelektrolytgerüst in einem Kationenaustauscher mit Oxoniumionen beladen,
so können bei neutraler Reaktion die Oxoniumionen gegen Kationen der
vorbeiströmenden Lösung ausgetauscht werden.
Sind
alle Gegenionen A durch die Gegenionen B ersetzt, so ist die
Austauschkapazität des Ionenaustauschers erschöpft, er muß regerneriert
werden.
Regenerieren des erschöpften Kationenaustauschers mit Säuren, eines
erschöpften Anionenaustauschers entsprechend mit Lauge.
Torfmoos Sphagnum als Ionenaustauscher - Hochmoor
Aufgaben zur Chemie der Kunststoffe
* Was versteht man unter einem Kunststoff?
** Welche strukturelle Voraussetzung müssen Monomere
besitzen, damit räumlich vernetzte Makromoleküle entstehen können?
*** Bei der Polymerisation eines Monomeren vom Typ CH2=CH-X
treten auch verzweigte Polymerketten auf. Überlegen Sie sich einen möglichen
Entstehungsmechanismus.
***
Monomere vom Typ CH2=CH-X können auch durch Zugabe von Säuren (Protonendonatoren)
polymerisiert werden. Stellen die Start- und die Wachstumsreaktion mit
Strukturformeln dar.
** Die folgenden Strukturformeln zeigen Ausschnitte aus
Kunststoffmolekülen. Geben Sie Strukturformeln und Namen der Monomeren an
und nennen Sie den Typ der Polyreaktion.
...-CCl2-CH2-CCl2-CH2-CCl2-CH2-...
...-CO-(CH2)4-CO-NH-(CH2)6-NH-CO-(CH2)4-...
...-CH2-CH(C6H5)-CH2-CH(C6H5)-....
...-NH-(CH2)4-NH-CO-O-(CH2)4-O-CO-NH-(CH2)4-...
...-CF2-CF2-CF2-CF2-..
Aus Styrol
wird durch Polymerisation Polystyrol hergestellt
a) Stellen Sie für diese Reaktion den Reaktionsmechanismus mit
Strukturformeln auf.
b) Als Starter für die Polymerisation wird Dibenzoylperoxid verwendet. Warum
ist der vielfach verwendete Ausdruck "Dibenzoylperoxid wirkt als
Katalysator" nicht korrekt?
c) Warum schmilzt Polystyrol nicht bei einer ganz bestimmten Temperatur?
d) Styrol polymerisiert nach längerer Zeit in der Aufbewahrungsflasche, auch
ohne Zugabe eines Starters. Stellen Sie Überlegungen an, wie das möglich
ist.
e) Welchen Einfluss auf Struktur und Eigenschaften des Polystyrols hat ein
Zusatz von p-Divinylbenzol CH2=CH-C6H4-CH=CH2
zum Styrol vor der Polymerisation?
f) Welchen Einfluss auf Struktur und Eigenschaften des Polystyrols hat eine
Erhöhung der Starterkonzentration?
Aus einem
Diisocyanat und einem Diamin kann durch Polyaddition ein Kunststoff
hergestellt werden. Stellen Sie für diese Reaktion eine mögliche
Strukturformelgleichung auf. |