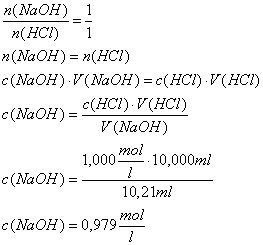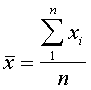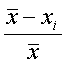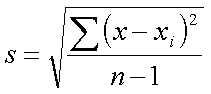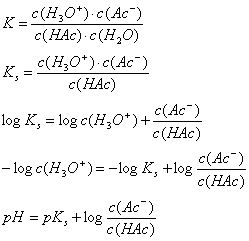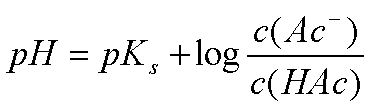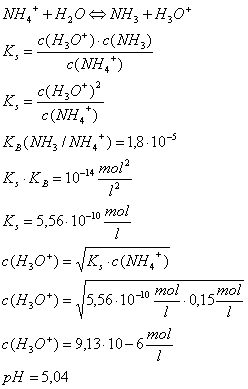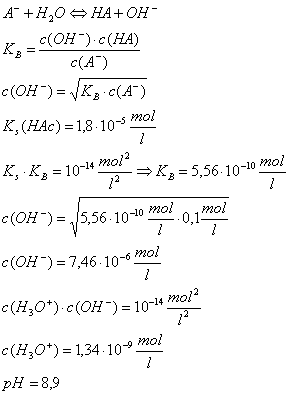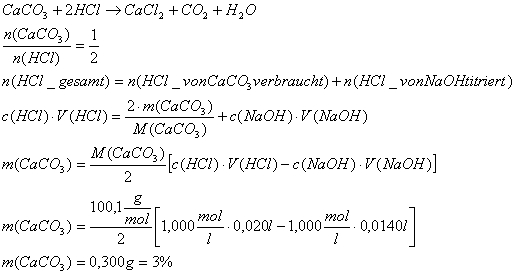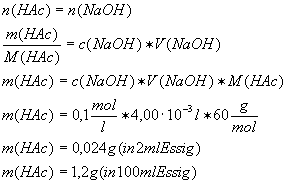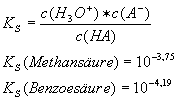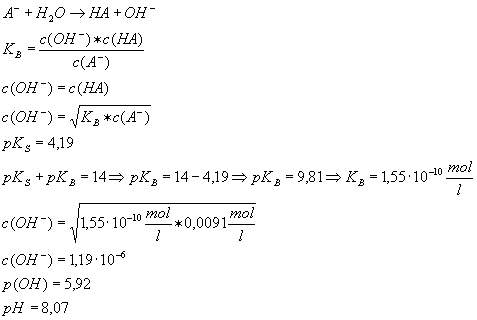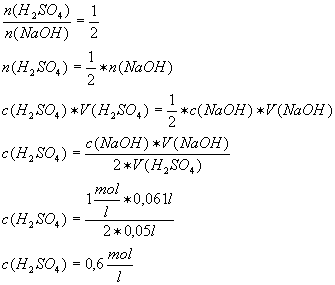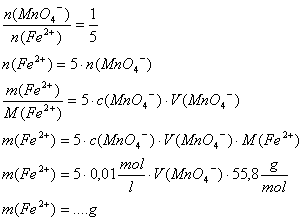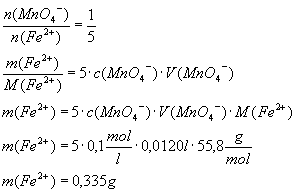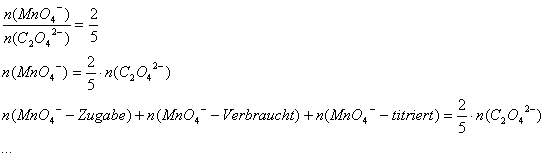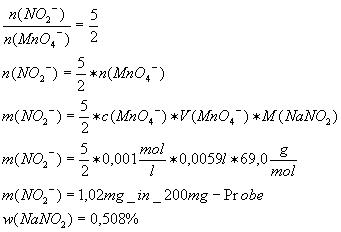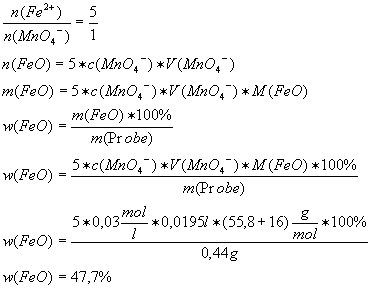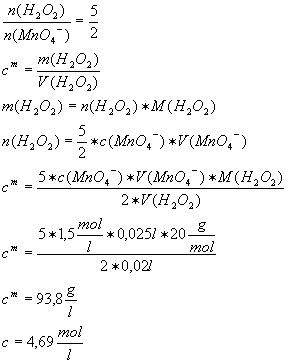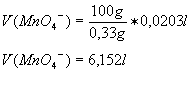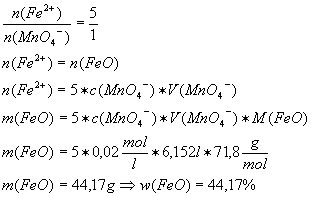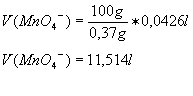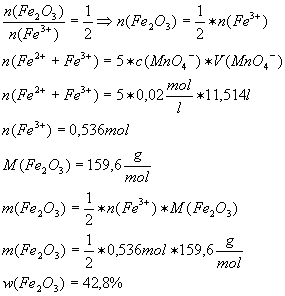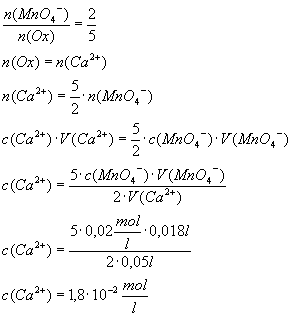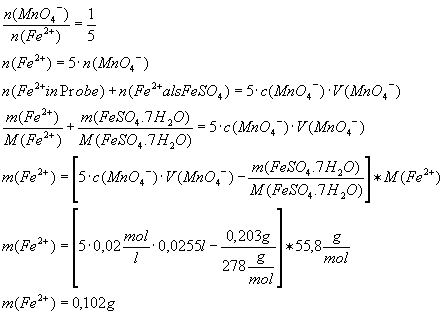Maßanalytische Verfahren,
Durchführung und
Auswertung von Titrationen
Grundlagen
Titration, Maßanalyse, Volumetrie:
Bestimmung der Stoffmenge eines gelösten Stoffes mit Hilfe einer Lösung
bekannter Konzentration (Titer, Maßlösung).
Bei der Titration lässt man so
lange Titrierflüssigkeit zu der Probe zutropfen, bis sämtliche Ionen der
Probe durch Reaktion mit Ionen der Titrierflüssigkeit verbraucht wurden (=
Äquivalenzpunkt).
Aus dem Verbrauch an
Titrierflüssigkeit bekannter Konzentration lässt sich der Gehalt der Probe
berechnen. Die Reaktion muss schnell und quantitativ erfolgen.
Wiederholung: Neutralisationstitration, pH-Wert
Bei der Titration einer Lauge
(Säure) lässt man zu der Probe so lange eine Säure (Lauge) bekannter
Konzentration zutropfen, bis am
Äquivalenzpunkt (praktisch) alle OH--Ionen (H30+-Ionen)
von H30+-lonen (OH--Ionen)
zu Wasser gebunden sind.
Der Aquivalenzpunkt ist am
Farbumschlag eines zugesetzten
Indikators (mit geeignetem Umschlagsbereich) zu erkennen.
H3O+ + OH-
--> 2 H2O
Oxoniumionen
Hydroxidionen
Ionenprodukt des Wassers:
c(H3O+) * c(OH-)
= 10-14 mol2/l2
Zur Beschreibung der sauren oder
basischen Eigenschaften einer Lösung dient der pH-Wert:
pH = - log c(H3O+)
Indikatoren
Säure-Base-Indikatoren
sind schwache Säuren oder Basen, deren Ion eine andere Farbe hat als die
undissoziierte Verbindung, z.B.
HInd
+ H2O <=> Ind- + H3O+
Das Umschlagsgebiet eines Indikators
umfasst einen Bereich von ca. 2 pH-Einheiten.
|
Indikator |
Umschlag bei pH |
Farbe |
| |
|
sauer |
neutral |
alkalisch |
|
Bromthymolblau |
6,8 |
gelb |
grün |
blau |
|
Phenolphthalein |
9,0 |
farblos |
farblos |
rot |
|
Methylorange |
3,8 |
rot |
orange |
orange |
Titration einer starken Base mit
einer starken Säure
Starke Basen sind z. B. Alkali- und
Erdalkalihydroxidlösungen. Sie können z.B. mit Salz-, Schwefel- oder
Salpetersäure titriert werden.
Beispiel:
Titration von Natronlauge
unbekannter Konzentration mit Salzsäure
Reaktionsgleichung:
Na+
+ OH- + H30+ + Cl- -> 2 H2O
+ Na+ + Cl-
Am Äquivalenzpunkt liegt eine
neutral reagierende Natriumchloridlösung vor. Zur Erkennung des
Äquivalenzpunkts verwendet man daher einen Indikator, der seinen
Umschlagspunkt im Neutralen, d. h. bei (oder nahe bei) pH = 7, wie z. B.
Bromthymolblau hat.
Neutralisation einer starken Base
mit einer schwachen Säure
Schwache Säuren sind meistens
organische Säuren.
Beispiel:
Neutralisation von Natronlauge mit
Ethansäure (Essigsäure) Reaktionsgleichung:
Na+
+ OH- + CH3COO- + H3O+ -> Na+
+ CH3COO- + 2 H2O
Am Äquivalenzpunkt reagiert die
Lösung schwach basisch. Die Ethanoationen sind Anionbasen und können
Wassermolekülen Protonen entreißen.
CH3COO-
+ H2O -> CH3COOH + OH-
Bei der Titration findet deshalb ein
Indikator mit einem Umschlagspunkt im Basischen, z. B. Phenolphthalein,
Anwendung.
Neutralisation einer schwachen
Base mit einer starken Säure
Beispiel:
Neutralisation von Ammoniakwasser
mit Salzsäure Reaktionsgleichung:
NH4+ + OH- + H3O+
+ Cl- -> NH4+ + Cl- + 2 H2O
Am Äquivalenzpunkt reagiert die
Lösung schwach sauer. Ammoniumionen sind Kationsäuren und können an
Wassermoleküle Protonen abgeben:
NH4+ + H2O -> NH3
+ H3O+
Der bei der Titration verwendete
Indikator muss daher seinen Umschlagspunkt im schwach Sauren haben (z.B.
Methylorange)
Ableitung des Zusammenhangs
zwischen pKs, pKb und Kw
Protolysegleichung für eine Base in
wässriger Lösung:
B + H2O --> HB+
+ OH-
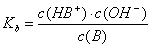
Protolysegleichung der konjugierten
Säure:
HB+ + H2O
--> H3O+ + B
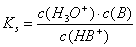
Multiplikation der beiden Konstanten
Ks und Kb:
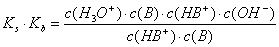
Ks*Kb
= c(H3O+)*c(OH-) = Kw = 10-14
[mol2/l2] => pKs + pKb = 14
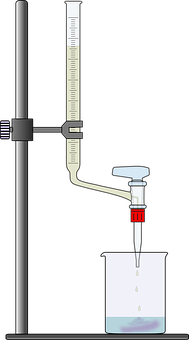
Versuch
(Praktikum): Titration einer Säure mit verschiedenen Indikatoren
Durchführung: 10,000 ml Salzsäure
der Konzentration c=0,100mol/l werden mit Natronlauge c = 0,100 mol/l bis
zum Umschlagspunkt des Indikators titriert. Bei Methylorange soll bis zum "Orangeton",
bei Bromthymolblau bis zum "mittleren Grünton" und bei Phenolphthalein bis
zum "ersten Auftreten der roten Farbe, die sich durch Schütteln nicht mehr
beseitigen lässt", titriert werden. Zur genauen Festlegung des Endpunktes
ist es nötig, jede Titration mindestens einmal zu wiederholen.
Auswertung:
Protokollierung der bei den drei
Indikatoren verbrauchten Laugenvolumina in tabellarischer Form und
Berechnung der Konzentration der Natronlauge in mol/l, in g/l und in
Prozent.
Lässt sich der Einfluss des
Indikators auf den Endpunkt der Titration nachweisen?
Protokollierung der Ergebnisse in
tabellarischer Form
| |
Indikator |
| Gruppe
|
Bromthymolblau
|
Phenolphthalein
|
Methylorange
|
| 1
|
10,3
|
10,2 |
10,15
|
| 2 |
10,3
|
10,2 |
10,2 |
| 3 |
10,25 |
10,25 |
10,25
|
| 4 |
10,0 |
10,2 |
10,2
|
Mittelwert aller Versuche: 10,21 ml
Berechnung der Konzentration der
Natronlauge:
In diesem Fall ist die Konzentration
der Salzsäure genau bekannt (1,000 mol/l), die Natronlauge wurde durch
Einwiegen von 40,0 g (=1mol) NaOH und Auffüllen auf 1 l hergestellt.
Auswertung: HCl + NaOH ->
NaCl + H2O
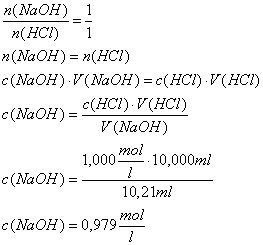
Genauigkeit und Zuverlässigkeit der Versuchsergebnisse - Fehlerbetrachtung
Messreihen mit den drei verschiedenen Indikatoren
lieferten unterschiedliche Mittelwerte.
Sind die Differenzen real oder nur
zufällig?
Abweichende Ergebnisse in den
einzelnen Gruppen - Annäherung an den "wahren" Wert durch das arithmetische
Mittel x der n Einzelmessungen xi.
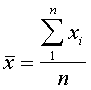
Abweichungen: Statistische Fehler
(Zufallsfehler) und systematische Fehler
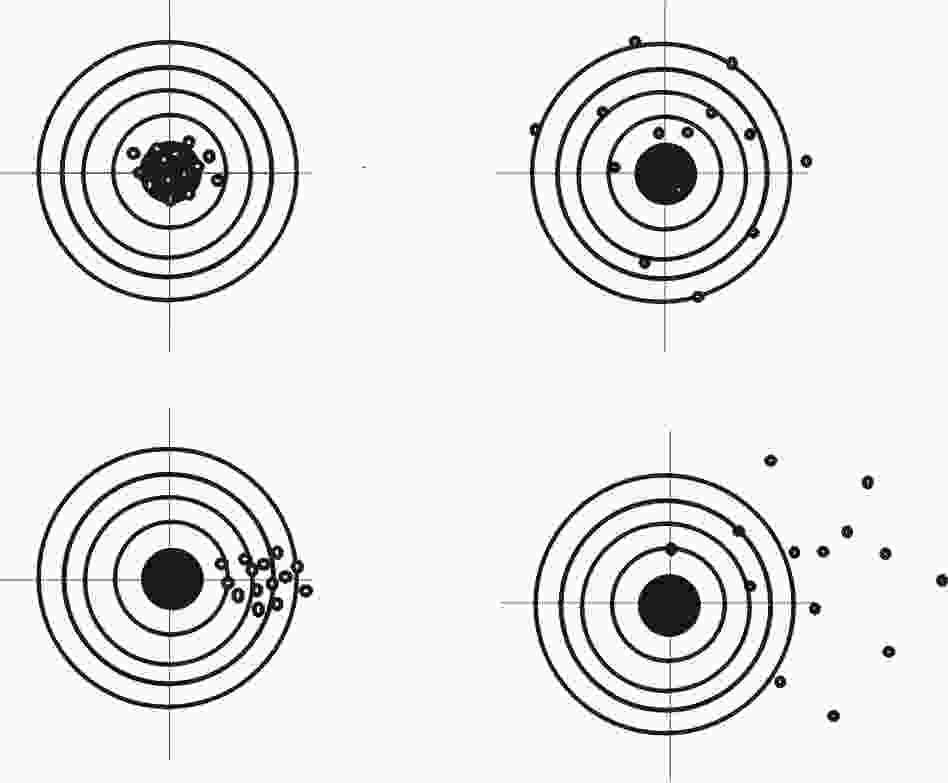
links oben:
statistischer Fehler klein, systematischer Fehler klein
rechts
oben: statistischer Fehler groß, systematischer Fehler klein
links
unten: statistischer Fehler klein, systematischer Fehler groß
rechts
unten: statistischer Fehler groß, systematischer Fehler groß
Ursachen für Versuchsfehler:
Systematische Fehler
verändern das Ergebnis immer in einer Richtung.
Mögliche Ursachen: z.B. ungenauer Titer der Lösung,
spezielle Arbeitsweise des Beobachters (Parallaxenfehler) usw.
Zufällige Fehler verursachen Schwankungen in beiden Richtungen.
Abhängigkeit von Sorgfalt und Erfahrung des Beobachters
Hinweise
für die Genauigkeit, d.h. Fehlergröße
Abweichung vom Mittelwert
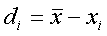
besser: relativer Fehler (Beziehung
zur Größe des Mittelwerts) /Beispiel?
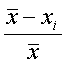
Bei einer größeren Zahl von
Einzelwerten:
Standardabweichung s
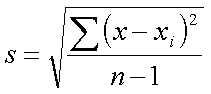
wenn n=1 wird der Nenner 0, d.h. die
Standardabweichung wird unbestimmt.
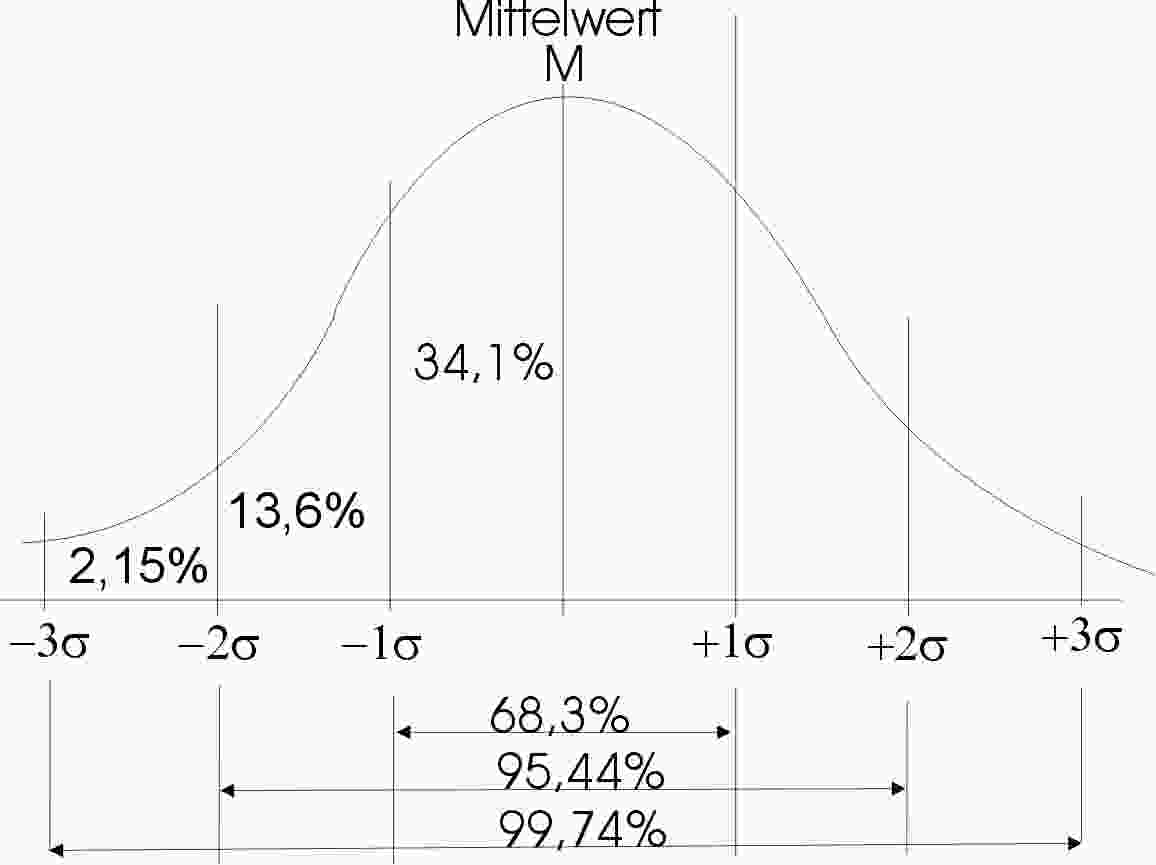
Normalverteilung (Zufalls- oder Binomialkurve).
Innerhalb des
Bereiches, den eine Standardabweichung oder Streuung (s) über und unter dem
Mittelwert (Scheitelpunkt der Kurve) begrenzt, häufen sich 68,26% (etwa 2/3)
aller Zufallsereignisse. 95,44% aller Ereignisse liegen innerhalb eines
Bereiches von M±2s. Nahezu 100% (99,75%) aller Zufallsereignisse fallen in
den Bereich von 3 Standardabweichungen unter und über dem Mittelwert, W1 und
W2 sind die Wendepunkte der Kurve.
3-s-Regel
als vereinfachter Signifikanztest: Zwei Mittelwerte sind dann
signifikant verschieden, wenn sie zumindest um den dreifachen Betrag der
Standardabweichung s voneinander abweichen.
Versuch: Variante mit
Tuberkulinspritzen und Pasteurpipetten - Vergleich mit der Genauigkeit,
die mit der Bürette erreicht wurde
2,00 ml Salzsäure c = 1,000 mol/l
werden in ein Aleteglas pipettiert. Zur Volumenvergrößerung Zugabe von ca.
50 ml dest. Wasser. Indikator: 3 Tr. Bromthymolblau
Unter Umschütteln Zutropfen von
Natronlauge (c = 1 mol/l) bis zum Farbumschlag nach grün-blau. Der
Farbumschlag muss den ganzen Kolbeninhalt erfassen.
Ablesen des verbrauchten
Natronlaugevolumens.
Gesucht ist die Konzentration der
Schwefelsäure in mol/l, in g/l und in Prozent.
Diskussion der Ergebnisse (Vergleich
mit den Ergebnissen, die mit der Bürette erzielt wurden)
Neutralisationskurve einer starken und einer
schwachen einprotonigen Säure
Versuch: Aufnahme der beiden
Titrationskurven (Ausdrucken, Kopieren)
Ableitung der
Henderson-Hasselbach-Gleichung (Wiederholung)
Berechnung von pH-Werten
1. Versuch: Titration einer starken
Säure mit einer starken Lauge:
10 ml Salzsäure c = 1 mol/l (in 90
ml Wasser) titrieren mit Natronlauge c = 1 mol/l
2. Versuch: Titration einer
schwachen Säure mit einer starken Lauge:
10 ml Essigsäure c = 1 mol/l (in 90
ml Wasser) titrieren mit Natronlauge c = 1 mol/l
Kurve 1: Berechnung einiger pH-Werte
pH-Wert in 0,1-molarer Salzsäure
(Anfangswert)?
HCl + H2O
-> H3O+ + Cl-
c(H3O+)
= c(HCl)
c(H3O+)
= 10-1
pH = - log c(H3O+)
pH = 1
Berechnung weiterer Kurvenpunkte und
Vergleich mit den experimentellen Ergebnissen
bei Zugabe von 9 ml Natronlauge: 90%
der ursprünglich vorhandenen Salzsäure neutralisiert - c(HCl)=0,01mol/l usw.
pH-Wert in neutraler Lösung:
H2O + H2O
-> H3O+ + OH-
c(H3O+)
= c(OH-)
c(H3O+)
* c(OH-) = Kw
c(H3O+)2
= Kw
c(H3O+)
= 10-7
pH = 7
pH in 0,1-molarer NaOH:
c(OH-) = c(NaOH)
c(H3O+)
* c(OH-) = Kw
c(H3O+)
= Kw / c(OH-)
c(H3O+)
= 10-14 / 10-1
c(H3O+)
= 10-13
pH = 13
Neutralisationskurve der
schwachen Säure
Protolysegleichung:
HAc + H2O -> H3O+
+ Ac-
Ableitung der Henderson-Hasselbach-Gleichung:
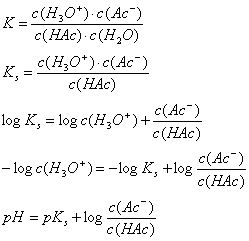
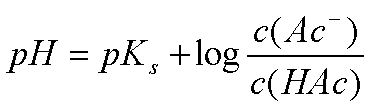
Wenn c(Ac-) = c(HAc) wird
pH = pKs!
Möglichkeit zur experimentellen
Bestimmung von Ks durch Halbtitration - Ablesen des pKs-Wertes
der Essigsäure aus der Neutralisationskurve
Pufferbereich?
Einfluß des Indikators auf den
Endpunkt der Titration?
Welcher Indikator ist für die
Titration von Essigsäure geeignet? (Phenolphtalein!)
Berechnung von pH-Werten
pH-Wert von starken Säuren und
Basen
Beispiel 1:
pH-Wert von HCl (c = 0,1 mol/l)
Beispiel 2:
pH-Wert von H2SO4 (c = 2 mol/l)
c(H3O+)
= 4 mol/l
pH = - log c(H3O+)
pH = - 0,6
Beispiel 3:
pH-Wert von Ba(OH)2 (c = 0,020 mol/l)
c(OH-) = 0,040
mol/l
c(H3O+)*c(OH-)
= Kw = 10-14 mol2/l2
pH + pOH = 14
pH = 14 - 1,40 =
12,6
pH-Wert der Lösung einer
schwachen Säure
Beispiel:
pH-Wert einer verd. Essigsäure der Konz. c = 0,1 mol/l
Ks = 1,8*10-5
mol/l
Ergebnis: pH = 2,87
pH-Wert der Lösung einer
schwachen Base
Beispiel:
pH-Wert von verd. Ammoniak der Konz. c = 0,1 mol/l
KB = 1,8*10-5
mol/l
Ergebnis: pH = 11,1
Berechnung des pH-Werts einer
Salzlösung
Beispiel 1: pH-Wert von NH4Cl-Lösung
der Konz. c = 0,15 mol/l
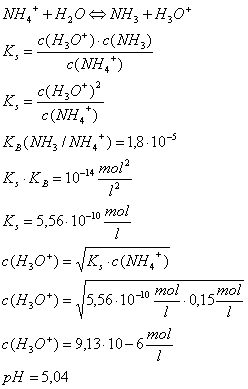
Beispiel 2:
pH-Wert von Natriumacetat-Lösung der Konz. c = 0,1 mol/l
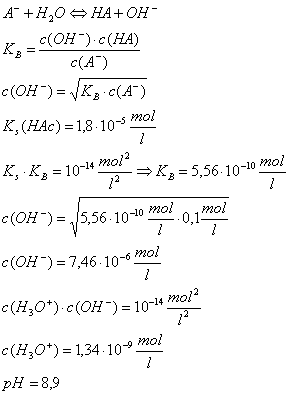
Versuch:
Bestimmung des Kalkgehalts einer Bodenprobe (Rücktitration)
Probenentnahme – repräsentativ
Probenvorbereitung: Trocknen (Lufttrocken), Zerkleinern,
Sieben
Diskussion von Möglichkeiten zur
Bestimmung des Kalkgehalts
(gravimetrisch, komplexometrisch,
titrimetrisch)
Rücktitration wegen Eigenfärbung der
Lösung
Durchführung:
-
10,00 g Probe + 20,00 cm3 HCl (c = 1,000 mol/l)
-
5 min rühren oder schütteln
-
filtrieren (dauert ziemlich lang!)
-
Filter 2 x mit dest. Wasser nachwaschen
-
Rücktitration der nicht verbrauchten Säure mit NaOH c = 1,000 mol/l
Mögliche Fehlerquellen?
Auswertung:
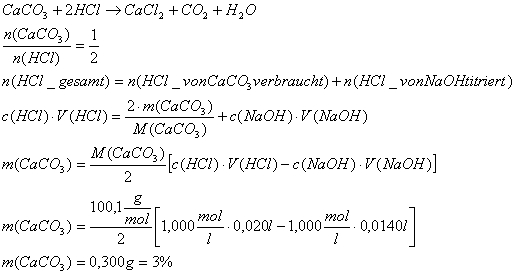
Aufgaben: Säure-Base-Titration
[A1]
20,0 ml Speiseessig
werden in einen 100 ml Messkolben gegeben. Dieser wird mit destilliertem
Wasser aufgefüllt. Eine 10,0 ml Probe dieser Lösung wird mit Natronlauge c
= 0,100 mol/l titriert. Verbrauch an Natronlauge: 4,00 ml. Wie viel Gramm
reine Essigsäure sind in 100 ml Speiseessig enthalten?
[Lösung]
[A2]
Wieso muss zur
Titration von Ethansäure (=Essigsäure) mit Natronlauge ein Indikator
verwendet werden, dessen Umschlagspunkt im schwach basischen Bereich liegt?
[Lösung]
[A3]
Gegeben sind die
pKs-Werte der folgenden Säuren:
pKs(Methansäure) =
3,75 pKs(Benzoesäure) = 4,19
a) [1] Welche von
beiden ist die stärkere Säure? (Begründung!)
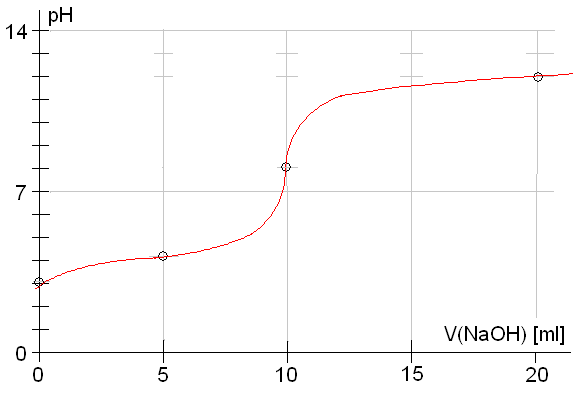
b) [10] Zu 0,001 Mol
Benzoesäure, gelöst in 100 ml Wasser, werden aus einer Bürette insgesamt 20
ml Natronlauge (c = 0,1 mol/l) zugegeben. Stellen Sie in einem Diagramm die
Abhängigkeit des pH-Werts vom zugegebenen Natronlauge-Volumen dar. Die
pH-Werte bei einem zugegebenen Natronlauge-Volumen von 0,0 ml und 5,0 ml und
10,0 ml sind genau anzugeben und wenn nötig zu berechnen.
c) [1] Welcher
Indikator wäre für die Titration von Benzoesäure mit Natronlauge geeignet?
(Begründung!)
[Lösung]
[A4]
Um die Konzentration
von 50 ml einer Schwefelsäure zu ermitteln, neutralisierte man diese mit
einer Natronlauge, die zuvor aus 40 g festem Natriumhydroxid durch Auffüllen
mit Wasser auf 1 l hergestellt wurde. Berechne die Konzentration der
Schwefelsäure, wenn zur Neutralisation 61,0 ml Natronlauge (hergestellt wie
oben angegeben) benötigt wurden.
[Lösung]
Lösungen zu den Aufgaben A1 - A4
[A1-Lösung]
HAc + NaOH
à NaAc + H2O
M(CH3-COOH) = 60
g/mol
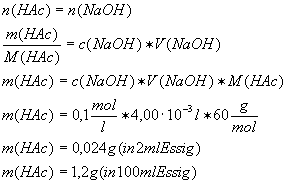
[A2-Lösung]
Beim Äquivalenzpunkt
liegen Acetationen vor, die in Wasser schwach basisch reagieren:
CH3-COO-
+ H2O <=> CH3-COOH + OH-
[A3-Lösung]
a) Methansäure ist
die stärkere Säure:
HA + H2O
<=> H3O+ + A-
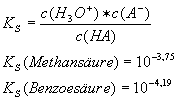
Vergleich beider
Zahlenwerte zeigt: Methansäure ist in wässriger Lösung in höherem Ausmaß
protolysiert.
b)
Berechnung des
pH-Werts bei einem Natronlauge-Volumen von 0,0 ml:
Anfangs-Konzentration der Benzoesäure: c = 0,01 mol/l
HA + H2O
à H3O+
+ A-

pH-Wert nach
Zugabe von 5,0 ml Natronlauge:
1 mmol Benzoesäure
benötigt für die vollständige Neutralisation 10,0 ml Natronlauge. Nach
Zugabe von 5,0 ml Natronlauge ist die Benzoesäure genau zur Hälfte
neutralisiert.
Nach der
Henderson-Hasselbach-Gleichung wird dann pH = pKS.
Also ist pH = 4,19
Berechnung des
pH-Werts bei einem Natronlauge-Volumen von 10,0 ml:
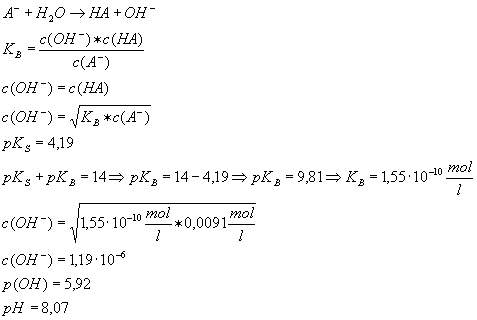
c) Indikator mit
Umschlagsbereich im schwach Alkalischen: z.B. Phenolphthalein
[A4-Lösung]
H2SO4
+ 2 NaOH -> Na2SO4 + 2 H2O
M(NaOH)=40 g/mol
=> c(NaOH)=
1 mol/l
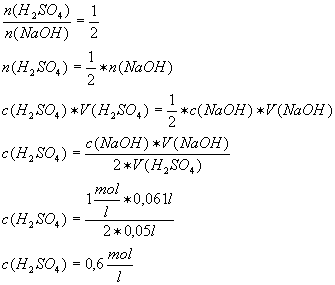
Redoxtitration, Manganometrie
| Lehrplan |
Reaktionen in saurer Lösung; Vorstellen des Prinzips der
Rücktitration; Hinweis auf Anwendungen, z.B. in der Wasseranalytik
(->U) . |
| Literatur |
1)
Schwedt/Schnepel: Analytisch-chemisches Umweltpraktikum (1981)
S.54-58
2)
Hütter: Wasser und Wasseruntersuchung S.57, 184
3)
Beer/Glöckner/Letterer: Chem. Analytik, Kernchemie,
Modellvorstellungen (1983) S.35 |
| Medien |
|
| Geräte |
Titrierspritzen |
| Chemikalien |
Eisen(II)-sulfat
Kaliumpermanganat 0,1 mol/l
Kaliumpermanganat 0,002 mol/l
Oxalsäure 0,005 mol/l
verd.Schwefelsäure |
Grundlage der Säure-Base-Titration:
Protonenübergang.
Elektronenübergang
ist Grundlage der Redoxtitration.
Prinzip: Eine oxidierbare Substanz wird mit Hilfe eines Oxidationsmittels
(Oxidator) bekannter Konzentration bestimmt, eine reduzierbare Substanz mit
Hilfe eines Reduktionsmittels bekannter Konzentration.
Erkennung des Endpunktes ist möglich,
wenn sich die Eigenfarbe der Lösung beim Äquivalenzpunkt ändert oder durch
Zugabe eines Redoxindikators.
Vorversuch:
Durchführung:
Eisen(II)-sulfatlösung, angesäuert mit verd. Schwefelsäure, wird mit
Kaliumpermanganat-Lösung versetzt.
Beobachtung:
Permanganat entfärbt sich, Gelbfärbung der Lösung; nach Zugabe von
Thiocyanatlösung: blutrote Färbung.
Ergebnis:
Eisen(II)-ionen werden von Permanganat-Lösung zu Eisen(III)-ionen oxidiert.
Die Permanganat-Ionen werden im Sauren zu Mangan(II)-ionen reduziert.
MnO4- + 5 e- + 8 H+
----------> Mn2+ + 4 H2O
5 Fe2+ ----------> 5 Fe3+
+ 5 e- /*5
---------------------------------------------------------------------------------
MnO4- + 5 Fe2+ + 8 H+
----------> Mn2+ + 5 Fe3+ + 4 H2O
Quantitativer Versuch:
Versuch: Manganometrische Bestimmung
von Eisen(II)-ionen
Aufgabenstellung:
- Wieviel Masse an Eisen in g ist in 1 g
Eisen(II)-sulfat enthalten? - Wie hoch ist der Kristallwassergehalt?
Durchführung:
10 ml einer Lösung von 1,000 g Eisen(II)-sulfat werden nach Ansäuern mit
verd. Schwefelsäure mit Kaliumpermanganat-Lösung c = 1 mol/l bis zur ersten
bleibenden Rosafärbung titriert.
Auswertung:
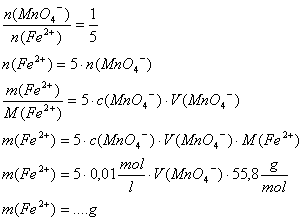
in 10 ml Probe
Zur Berechnung des Kristallwassergehalts:
FeSO4 * x H2O
Zuerst M (FeSO4 * x H2O)
berechnen!
Aufgabe (Praktikum):
Bestimmung des Eisengehalts (Massenanteil in
Prozent) in Ammonium-Eisen(II)-sulfat (= Mohrsches Salz) FeSO4(NH4)2SO4.6H2O
und Vergleich mit der Theorie
AES [M =
392,14 g/mol]
KMnO4
[M = 158,0 g/mol]
Material:
Kaliumpermanganat-Lösung c = 0,100 mol/l [15,800 g/l]
2-3 g AES
pro Gruppe (auf mg gewogen)
Schwefelsäure verd.
Titrierausstattung
Durchführung:
Probe AES
in dest. Wasser lösen, ansäuern mit ca. 5 ml verd. Schwefelsäure, titrieren
mit KMnO4-Lösung c = 0,1 mol/l bis zur bleibenden Rosafärbung.
Auswertung:
8 H+
+ MnO4- + 5 e-
à Mn2+ + 4 H2O
5 Fe2+
à 5 Fe3+ + 5 e-
---------------------------------------------------------------------------
MnO4-
+ 5 Fe2+ + 8 H+
à Mn2+ + 5 Fe3+
+ 4 H2O
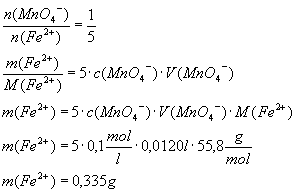
Massenanteil Eisen: 14,4 % (Theorie: 14,2%)
Prinzip: Zu der zu bestimmenden Probe wird ein abgemessener Überschuss an
Maßlösung zugesetzt. Der nicht verbrauchte Anteil der Maßlösung wird
anschließend titriert.
Versuch:
Bestimmung des Gehalts organischer Stoffe in Wasserproben
Der Verschmutzungsgrad der Gewässer wird
häufig durch den „Permanganatverbrauch“ gekennzeichnet. Damit werden die
leicht oxidierbaren organischen Stoffe in verschmutztem Wasser erfaßt. Da
aber auch einige anorganische Ionen oxidiert und manche organischen
Verbindungen unter diesen Bedingungen nicht oxidiert werden, bietet er aber
nur einen ungefähren Anhaltspunkt für den Umfang der Gewässerverschmutzung.
Da die Oxidation einige Zeit beansprucht, wird eine Rücktitration
durchgeführt (Vorschrift geändert!):
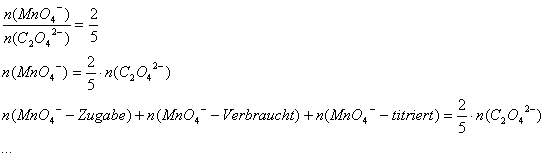
1 unsprünglich vorhandenes Permanganat
2 organische Stoffe verbrauchen einen Teil des
Permanganats
3 Zugabe einer äquivalenten Menge Oxalsäure
4 Die mit Kaliumpermanganat bestimmte
Oxalsäure entspricht dem Grad der Verschmutzung mit organischen Stoffen
Durchführung:
- 50 ml Wasserprobe + 10 ml verd.
Schwefelsäure zum Sieden erhitzen (Kochplatte oder Dreifuß, Drahtnetz und
Bunsenbrenner)
- Zugabe von 10 ml Permanganatlösung c=0,002
mol/l
- 10 min kochen lassen (Stoppuhr!)
-> + 10 ml Oxalsäure c=0,005 mol/l ->
Entfärbung
-> Titration mit Permanganatlösung c=0,002
mol/l in der Hitze bis zur bleibenden Rosafärbung
Erklärung: In verschmutztem Wasser wurde ein
Teil der zugesetzten Permanganatlösung verbraucht. Das Volumen der
verbrauchten Permanganatlösung ist der Verschmutzung proportional.
Vergleichswert: 1 g Glucose verbraucht 2,35 g Kaliumpermanganat.
Auswertung:
5 H2C2O4
-> 10 CO2 + 10 H+ + 10 e- /*5
2 MnO4- + 10 e-
+ 16 H+ -> 2 Mn2+ + 8 H2O /*2
----------------------------------------------------
2 MnO4-
+ 5 H2C2O4 + 6 H+ -> 2 Mn2+
+ 10 CO2 + 8 H2O
Berechnung des von den organischen
Verunreinigungen verbrauchten Permanganats in mg/l (bei äquivalenten Mengen
viel einfacher!):
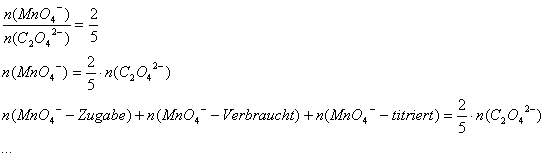
Herstellung der Reagenzien
1) 1 l Permanganatlösung c=0,002 mol/l
M(KMnO4)=158,04g/mol
0,316 g KMnO4 in 1-l-Messkolben mit demin. Wasser
auf 1000,0 ml auffüllen.
2) Oxalsäurelösung c=0,005 mol/l
M(H2C2O4.2H2O)=126,07
0,630 g H2C2O4.2H2O
in 1-l-Messkolben mit demin. Wasser auf 1000,0 ml auffüllen.
Die
beiden Maßlösungen sollten im Volumenverhältnis 1 : 1 reagieren (prüfen!)
Versuch zur Durchführung im Reagenzglas - "en miniature"
Herstellung der Reagenzien
1) 100 ml Permanganatlösung c=0,02 mol/l
M(KMnO4)=158,04g/mol
0,316 g KMnO4 in 100 ml-Messkolben mit demin.
Wasser auf 100,0 ml auffüllen.
2) Oxalsäurelösung c=0,05 mol/l
M(H2C2O4.2H2O)=126,07
0,630 g H2C2O4.2H2O
in 100 ml-l-Messkolben mit demin. Wasser auf 100,0 ml auffüllen.
oder bei wasserfreier Oxalsäure:
0,450 g H2C2O4.2H2O
in 100 ml-l-Messkolben mit demin. Wasser auf 100,0 ml auffüllen.
Die
beiden Maßlösungen sollten im Volumenverhältnis 1 : 1 reagieren (prüfen!)
In ein großes Reagenzglas:
20 ml Wasserprobe
+ 1 ml konz. Schwefelsäure
in siedendes Wasserbad einstellen
wenn Siedetemperatur erreicht:
- Zugabe von 2,00 ml Permanganatlösung c=0,02
mol/l = 2 Spritzenfüllungen
- genau 10 min weiter im siedenden Wasserbad
stehen lassen. Wenn Entfärbung eintritt, rechtzeitig weiteres Permanganat
zugeben.
- nach genau 10 min eine dem zugesetzten
Permanganat äquivalente Menge Oxalsäure zugeben: 2,00 ml Oxalsäurelösung
c=0,05 mol/l.
Die Lösung wird farblos.
- anschließend noch heiß mit Permanganatlösung
bis zur bleibenden Rosafärbung titrieren.
Berechnung des Permanganatverbrauchs in mg/l
Ergebnis-Bewertung:
Reine Quell- und Grundwässer: 3-8 mg/l
Trinkwasser: > 12 mg/l bedenklich
reine Oberflächengewässer: 8-12 mg/l
mäßig verunreinigte Flüsse: 20-35 mg/l
stark verunreinigte Flüsse: 100-150 mg/l
Fehlerquellen, Störungen diskutieren
Oxidationsreaktionen (durch Permanganat)
| NO2-
à
NO3- |
NitritàNitrat |
| SO32-
à
SO42- |
SulfitàSulfat |
| H2O2
à
O2 |
WasserstoffperoxidàSauerstoff |
| H2C2O4
à
CO2 |
OxalsäureàKohlenstoffdioxid |
| C2O42-
à
CO2 |
OxalatàKohlenstoffdioxid |
| I-
à
I2 |
IodidàIod |
| Fe2+
à
Fe3+ |
Eisen(II)
àEisen(III) |
Versuche - Aufstellung der Redoxgleichungen
[A5]
Verschiedene
Fleisch- und Wurstwaren enthalten einen geringen Nitritzusatz, damit diese
die rote Farbe behalten. Damit es nicht zu einer gesundheitsgefährdenden
Überdosierung kommen kann, wird als Nitritpräparat das sogenannte
Nitritpökelsalz verwendet, ein gleichmäßiges Gemisch aus Kochsalz mit 0,5 -
0,6 % Massenanteil Natriumnitrit.
Der Nitritgehalt
eines Pökelsalzes soll manganometrisch bestimmt werden. Dazu wird eine Probe
von 200 mg in Wasser gelöst und nach Ansäuern mit Kaliumpermanganatlösung
der Konzentration c = 0,001 mol/l titriert. Der Verbrauch an
Kaliumpermanganat-Lösung betrug 5,9 ml.
a) [5] Stellen Sie
für die Reaktion von Permanganat mit Nitrit Gleichungen auf!
b) [8] Berechnen Sie
den Massenanteil an Natriumnitrit im untersuchten Pökelsalz in Prozent und
prüfen Sie, ob er im gesetzlich zulässigen Bereich zwischen 0,5 und 0,6
Prozent liegt!
[Lösung]
[A6]
In einem Erz soll
der Eisen(II)-oxid-Gehalt analysiert werden. Dazu werden 0,44 g des Erzes in
Säure aufgelöst und mit 19,5 ml Kaliumpermanganatlösung von der
Konzentration c = 0,03 mol/l bis zum Erreichen des Äqivalenzpunktes
titriert. Berechne den prozentualen Eisen(II)-oxid-Gehalt im Erz.
[Lösung]
[A7]
Welche Konzentration
in Gramm pro Liter hat eine Wasserstoffperoxidlösung, von der 20 ml nach
Ansäuern gerade 25,0 ml einer Kaliumpermanganatlösung der Konzentration c =
1,5 mol/l entfärben? [Ergebnis: 4,69 mol/l]
[Lösung]
[A8]
Zur vollständigen
Oxidation einer Oxalsäurelösung wurden 27.4 ml Kaliumpermanganatlösung der
Konzentration c=0,02 mol/l benötigt. Wie groß war die Masse der Oxalsäure,
die sie sich in der Lösung befand?
[A9] Abitur 1997 I
1.3 Neben dem
Tensid und anderen Komponenten sind in einem Vollwaschmittel auch
Bleichmittel enthalten. Diese bestehen im wesentlichen aus Natriumperborat
(NaBO2 . H2O2 . 3 H2O).
Beim Waschvorgang
zerfällt bei Temperaturen über 60°C das gebundene Wasserstoffperoxid,
wodurch farbige Verschmutzungen auf der Faser oxidativ zerstört werden.
Der Gehalt an
Perborat im Waschmittel kann durch Titration in schwefelsaurem Milieu mit
Kaliumpermanganatlösung bestimmt werden.
1.3.1 [3BE]
Entwickeln Sie aus Teilgleichungen die Reaktionsgleichung für diese
Bestimmung!
1.3.2 [6BE] Zur
Bestimmung des Bleichmittelgehalts werden 500 mg Vollwaschmittel in Wasser
gelöst, die Lösung mit Schwefelsäure angesäuert und dann mit
Kaliumpermanganatlösung der Konzentration c(KMnO4) = 0,002 mol/1
titriert. Der Verbrauch an Maßlösung beträgt 117,6 ml.
Berechnen Sie in
Prozent den Massenanteil des Natriumperborats im Waschmittel!
[A10] Abiturprüfung 1990
Aufgabe IV
1.Zur Bestimmung des
Eisengehalts einer Legierung werden 0,178g der Legierung unter Schutzgas in
verd. Schwefelsäure gelöst. Das Eisen geht dabei in Eisen(II)-Ionen über.
Zur Bestimmung des
Gehalts an Eisen(II)-Ionen wird die Lösung mit einer Kaliumpermanganatlösung
titriert. Der Verbrauch beträgt 6,13 ml. Bei dieser Titration stören die
anderen Legierungsbestandteile nicht.
Die
Stoffmengenkonzentration der Kaliumpermanganatlösung wurde zuvor mit einer
Oxalsäurelösung bekannter Konzentration ermittelt. Dabei wurden 9,75 ml der
Permanganatlösung durch 10ml Oxalsäurelösung der Konzentration c(H2C2O4)=5*10-2
mol/l reduziert. Die Oxalsäure wird dabei zu Kohlenstoffdioxid oxidiert.
1.1 Stellen Sie für
die drei genannten Reaktionen die Gleichungen auf! (6 BE)
1.2 Berechnen Sie
den Eisengehalt der Legierung in Massenprozent! (6 BE) (Ergebnis: 19,7 %)
[A11] Abiturprüfung 1983 III
1.
Ein bestimmtes Erz
enthält unter anderem die Eisenoxide FeO und Fe2O3;
die übrigen Bestandteile des Erzes stören die Untersuchung nicht.
Bei der Analyse des
Erzes werden im ersten Schritt 0,33 g unter Schutzgas (Stickstoff) in
Schwefelsäure gelöst und mit einer Kaliumpermanganatlösung der Konzentration
c(KMnO4)=0,02 mol/l titriert, von der 20,3 ml verbraucht werden.
Im zweiten Schritt
der Analyse werden 0,37 g Erz unter Schutzgas in Schwefelsäure gelöst und
die dreiwertigen Eisenionen zu zweiwertigen reduziert. Zur Titration werden
jetzt 42,6 ml der Kaliumpermanganat-Lösung verbraucht.
1.1 Stellen Sie die
Reaktionsgleichung für den Redoxvorgang zwischen Eisen(II)-Ionen und
Permanganat-Ionen auf! (3BE)
1.2 Berechnen Sie
die Massenanteile (in Prozent) der beiden Eisenoxide im Erz! Der Gang der
Berechnung muss ersichtlich sein. (11BE)
[Ergebnis: 44,16%
FeO, 42,8% Fe2O3]
[Lösung]
[A12] Abiturprüfung
1984_ I_ 1. Der Calcium-Gehalt einer Wasserprobe
soll manganometrisch bestimmt werden. Zu diesem Zweck werden 50 ml des zu
untersuchenden Wassers mit Ammoniumoxalatlösung versetzt. Dadurch werden die
Calcium-Ionen quantitativ gefällt. Der Niederschlag wird abfiltriert,
gewaschen und anschließend mit verdünnter Schwefelsäure aufgelöst. Bei der
darauffolgenden Titration mit mit Kaliumpermanganatlösung der Konzentration
c(KMnO4)=0,02 mol/l geht die Oxalsäure quantitativ in
Kohlenstoffdioxid über. Dabei werden 18 ml der Maßlösung verbraucht.
1.1 Stellen Sie die
Gleichung für die Reaktion von Kaliumpermanganat mit Oxalsäure auf! (4 BE)
1.2 Berechnen Sie
die Stoffmengenkonzentration an Calcium-Ionen in dem untersuchten Wasser!
Der Gang der Berechnung muss ersichtlich sein. (7 BE) [Ergebnis: 1,8*10-2
mol/l]
[Lösung]
[A13] Abiturprüfung
1996_ III_1
1 In einem Labor
werden Wasserproben auf ihren Gehalt an Eisen(II)-Ionen kontrolliert. Dazu
nimmt man 25 ml der Probe, versetzt sie mit verdünnter Schwefelsäure und
titriert mit einer Kaliumpermanganat-Lösung der Konzentration c(KMnO4)
= 0,02 mol/l. Dabei wird versehentlich übertitriert. Um das Mißgeschick zu
korrigieren, werden der Probe 0,203 g Eisen(II)-sulfatheptahydrat (FeSO4
- 7 H2O) zugesetzt. Dann wird mit der genannten
Kaliumpermanganat-Lösung weitertitriert, bis alle Eisen(II)-Ionen oxidiert
sind.
Der Gesamtverbrauch
an Permanganat-Lösung beträgt 25,5 ml.
1.1 [3 BE] Erstellen
Sie für diese manganometrische Bestimmung die Reaktionsgleichung, und legen
Sie dar, wie der Endpunkt der Titration erkannt werden kann!
1.2 [5 BE] Berechnen
Sie die Masse der Eisen(II)-Ionen in der Wasserprobe! Der Gang der
Berechnung muss klar ersichtlich sein.
[Lösung]
Lösungen zu den Aufgaben A5,A6,A7,,,,A11,A12,A13
[A5 Lösung]
5 H2O + 5 NO2-
-> 5 NO3- + 102 e- + 102
H+ /*5
2 MnO4- +
105 e- + 168 H+ -> 2 Mn2+
+ 84 H2O /*2
-------------------------------------------------------
5 NO2- + 2
MnO4- + 6 H+ -> 5 NO3-
+ 2 Mn2+ + 3 H2O
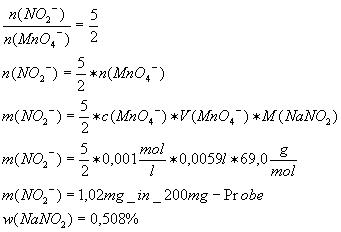
[A6 Lösung]
Fe2+
-> Fe3+ + e-
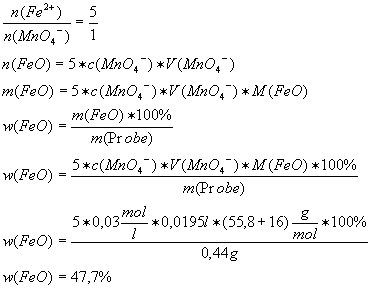
[A7 Lösung]
5 H2O2 -> 5
O2 + 102 e- + 102 H+ /*5
2 MnO4- +
105 e- + 168 H+ -> 2 Mn2+
+ 84 H2O /*2
---------------------------------------------------------
5 H2O2 + 2
MnO4- + 6 H+ -> 5 O2 + 2
Mn2+ + 8 H2O
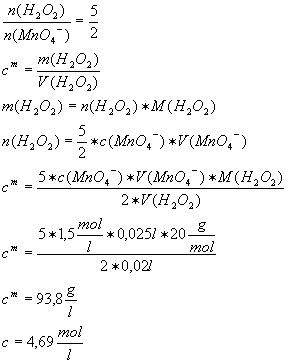
[A8 Lösung]
[A9 Lösung]
[A10 Lösung]
[A11 Lösung]
1.1
5 Fe2+ -> 5 Fe3+ + 5 e-
/*5
8 H+ + MnO4- +
5 e- -> Mn2+ + 4 H2O
------------------------------------------------------
5 Fe2+ + MnO4-
+ 8 H+ -> 5 Fe3+ + Mn2+ + 4 H2O
1.2
a)
Berechnung des Massenanteils an FeO
Verbrauch an
Permanganat-Lösung, bezogen auf 100 g Erz:
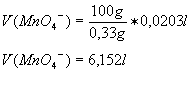
damit
errechnet sich der Massenanteil an FeO:
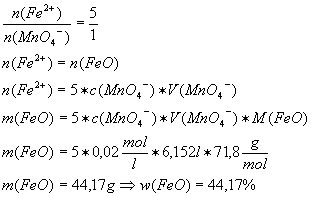
b)
Berechnung des Massenanteils an Fe2O3
Verbrauch an
Permanganat-Lösung, bezogen auf 100 g Erz:
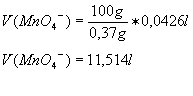
damit
errechnet sich der Massenanteil an Fe2O3:

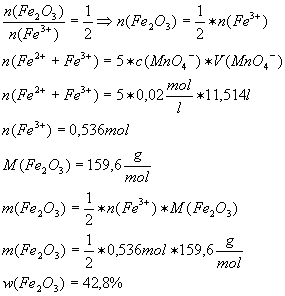
[A12 Lösung]
2 MnO4- + 10 5 e-
+ 16 8 H+ -> 2 Mn2+ + 8 4 H2O
/ *2
5 H2C2O4 -> 10
2 CO2 + 10 2 CO2 + 10 2 H+
+ 10 2 e- / *5
--------------------------------------------------------------
2 MnO4- + 5 H2C2O4
+ 6 H+ -> 2 Mn2+ + 10 CO2 + 8 H2O
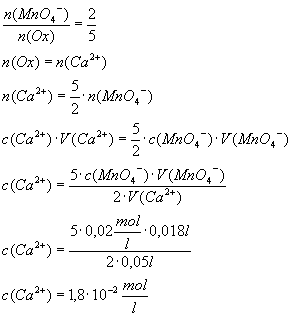
[A13 Lösung]
MnO4- + 5 e- +
8 H+ -> Mn2+ + 4 H2O
5 Fe2+ -> 5 Fe3+ + 5 e-
/*5
--------------------------------------------------------------------
MnO4- + 5 Fe2+
+ 8 H+ -> Mn2+ + 5 Fe3+ + 4 H2O
Erkennung des Endpunkts der
Titration: bleibende Rosafärbung (violett)
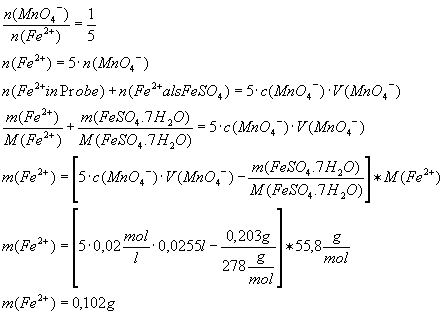 |