Isolierung eines Reinstoffes
Wiederholung: Einteilung der
Stoffgemische und Trennungsverfahren
|
Aggregat-
zustände
(Phasen) |
fest |
flüssig |
gasförmig |
|
fest in |
(festes)
Gemenge
|
homogen:
Lösung
(Destillation)
heterogen:
Suspension
(Filtration)
|
Rauch,
Staub |
|
flüssig
in |
Gel |
homogen:
Lösung
Destillation
heterogen:
Emulsion
(Scheidetrichter)
|
Nebel |
|
gasförmig in |
poröses
Material |
homogen
Lösung
heterogen
Schaum
|
Gasgemisch |
Welche Eigenschaftsunterschiede
werden genützt?
Spezielle Trenn- und
Reinigungsverfahren:
mögliche
Aufgabenstellungen
- Fraktionierte Destillation von
Wein -> Ethanol
- Soxhlet-Extraktion von
Kokosflocken -> Kokosfett
Apparaturen zur Stofftrennung und
-reinigung
Qualitative
Elementaranalyse
Ermittlung der am Molekülaufbau beteiligten Elemente
Kohlenstoff
a) Erhitzen der Substanz auf Platinblech: Verbrennung
mit Flamme oder Zersetzung unter Abscheidung von schwarzem Kohlenstoff.
b) Erhitzen mit Kupfer(II)-oxid (ausgeglüht, fein) im
Rggl. mit Gasableitungsrohr und Kalkwasser: Das gebildete Kohlenstoffdioxid
bewirkt Trübung durch Calciumcarbonat (gleichzeitig Nachweis von Wasserstoff
s.u.)
(C)geb. + 2 CuO
à
CO2 + 2 Cu
CO2 + Ca(OH)2
à
CaCO3 + H2O
Wasserstoff
Beim Erhitzen der Substanz mit Kupfer(II)-oxid
Abscheidung von Wasser im oberen, kalten Teil des Reagenzglases:
2 (H)geb. + 2 CuO
à
H2O + 2 Cu
Stickstoff
Verschmelzen der Substanz mit metallischem Natrium
(VORSICHT!) - LASSAIGNE-Probe.
Bei starkem Erhitzen (Rotglut) bildet sich mit dem
stets vorhandenen Kohlenstoff das thermisch stabile Natriumcyanid, das in
Wasser gelöst und mit wenig Eisen(II)-salz zum Hexacyanoferrat(II)-Komplex
umgesetzt wird. Nach Filtrieren, Ansäuern und Zugabe von Eisen(III)-salz
bildet sich Berlinerblau:
+ Fe2+
+ Fe3+
(N)geb.
à
CN-
à
[Fe(CN)6]4-
à
Fe4[Fe(CN)6]3
Berliner Blau
Schwefel
bildet bei der LASSAIGNE-Probe Natriumsulfid.
Aufschlußlösung mit Essigsäure ansäuern, Blei(II)-acetatlösung zugeben -
eine schwarze Fällung beweist Schwefel:
(S)geb.
à
S2-
à
PbS
Halogen
BEILSTEIN-Probe: Probe mit einem glühenden Kupferdraht
aufnehmen - sie zersetzt sich und das Halogen bildet mit dem Kupfer
flüchtiges Kupfer(I)-halogenid, das die Flamme grün färbt. (alternativer
Versuch mit Spritze!)
Quantitative
Elementaranalyse: Prinzip der Verbrennungsanalyse
Umwandlung des qualitativen
Nachweisverfahrens in ein quantitatives
Problem: Verbrennung in reinem
Sauerstoff führt häufig zur Explosion, bei geringer Sauerstoffzufuhr bleibt
die Verbrennung unvollständig.
Verbrennungsanalyse von LIEBIG
(1831)
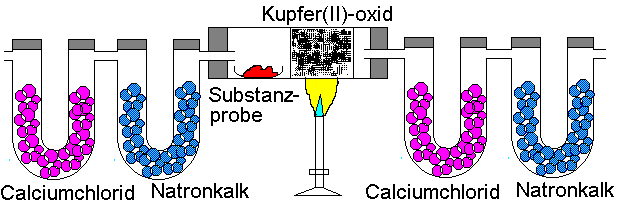
Die Probe wird in einem Rohr
verbrannt, das mit Kupfer(II)-oxid beschickt ist. Durch das Rohr wird ein
langsamer Sauerstoffstrom geleitet, der einen Teil der Substanz unmittelbar
verbrennt; vollständige Oxidation wird durch Kontakt mit rotglühendem
Kupfer(II)-oxid als Oxidationsmittel erreicht. Metallisches Kupfer wird
durch den Sauerstoff wieder in Kupferoxid zurückverwandelt.
Nach der Verbrennung werden die
Absorptionsgefäße gewogen.
Beispiel: Die Verbrennung von 3,525
mg Ethanol lieferte 6,750 mg Kohlenstoffdioxid und 4,112 mg Wasser
Auswertung:
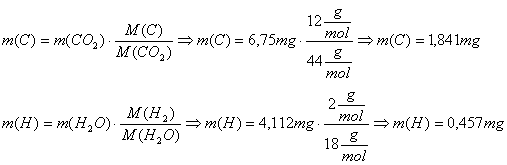
Die Masse des Sauerstoffs in der
eingewogenen Substanz ergibt sich als Differenz zwischen Einwaage und den
gefundenen Werten für Kohlenstoff und Wasserstoff, wenn außer Sauerstoff
keine weiteren Elemente in der Verbindung enthalten sind:
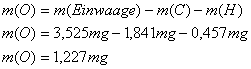

Aufgaben:
Abitur 1995 I 1.
Die qualitative Elementaranalyse
einer Verbindung X ergibt, dass in ihren Molekülen Kohlenstoff-,
Wasserstoff-, Stickstoff- und Sauerstoff-Atome gebunden sind. Bei der
vollständigen Oxidation von 122,0 mg der Verbindung X entstehen 84,6 mg
Wasser und 155,1 mg Kohlenstoffdioxid. Der Stickstoffanteil der Verbindung
X wird in einem weiteren Analyseschritt in elementaren Stickstoff
übergeführt; bei der Einwaage von 115,0 mg der Verbindung X entstehen 24,7
ml Stickstoff (Normzustand).
Berechnen Sie die empirische Formel
(Verhältnisformel) der Verbindung X! Der Gang der Berechnung muss klar
ersichtlich sein. [6 BE]
Ergebnis:(C3H8O2N2)x