|
Spektroskopie
Grundlagen der Spektroskopie
Spektroskopische Verfahren
beruhen auf Wechselwirkungen zwischen elektromagnetischen Strahlen und
Materie.
Die Natur der elektromagnetischen Strahlen
(elektromagnetische Wellen)
Nach dem Wellenmodell besteht die elektromagnetische
Strahlung aus sich periodisch ändernden elektrischen und magnetischen
Feldern, die sich im Raum (im Vakuum mit der Lichtgeschwindigkeit c = 3*108
m/s) ausbreiten. Scheinbar unterschiedliche Formen von Strahlung, wie
Radiowellen, Infrarot-(IR-)Strahlung, sichtbares Licht, ultraviolette (UV-)
und Röntgenstrahlung unterscheiden sich in ihrer Wellenlänge
l, (dem Abstand zwischen zwei
aufeinanderfolgenden Punkten gleicher Phase, z. B. dem Abstand zwischen zwei
Wellenbergen) und damit in ihrer Schwingungshäufigkeit (Frequenz)
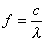
Nach der Korpuskel-Theorie besteht die Strahlung aus
einem Strom kleinster Teilchen. Die Strahlungsenergie kann (nach der
Quantentheorie) nicht kontinuierlich, sondern in Form kleinster Quanten
(kleinste Energieportionen) abgegeben (emittiert) oder aufgenommen
(absorbiert) werden.
Die Energie eines Quants hängt von der Frequenz bzw.
Wellenlänge der Strahlung ab nach:
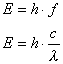
Die Konstante h ist das Plancksche Wirkungsquantum:
(h = 6,62.10-34 J*s).
Das Spektrum des sichtbaren Lichtes (Wellenlänge
in nm)

Wechselwirkung zwischen Strahlung und
Materie
Absorption
Atome und Moleküle können Strahlungsenergie aufnehmen
und sie in eine andere Energieform umwandeln. Das absorbierende Atom oder
Molekül wird in einen energiereichen (angeregten) Zustand übergeführt.
Die Differenz zwischen den verschiedenen
Energiezuständen nimmt nur bestimmte Energiebeträge an. Nur Quanten, deren
Energieinhalt genau diesen Energiebeträgen (Anregungsenergie) entspricht
(also z. B. Licht, das eine bestimmte Frequenz/Wellenlänge besitzt), können
Atome oder Moleküle anregen, werden also von ihnen absorbiert.
Charakteristische Muster absorbierter Strahlung
(Absorptionsspektren) können zur Identifizierung von Substanzen beitragen
und bilden eine Grundlage der Spektralanalyse.
Die Energieabsorption führt zu verschiedenen Formen
angeregter Zustände:
- Anregung von
Elektronen (Anheben auf
höhere Energieniveaus) durch UV- und sichtbares Licht (Emissions- und
Absorptionsspektroskopie)
- Anregung von
Schwingungen der Atome
innerhalb von Molekülen durch IR-Strahlung (IR-Spektroskopie)
- Anregung von
Molekülrotationen durch
Mikrowellen
- Änderung der Orientierung des
Kemspins in einem äußeren
Magnetfeld durch Radiowellen (Kernresonanzspektroskopie).
Emission
Bei Energiezufuhr können Atome oder Moleküle Licht
emittieren.
Z.B. bei (freien) Atomen führt diese Energiezufuhr die
(äußeren) Elektronen in bestimmte angeregte Energiezustände über. Dabei
können die Atome aus dem breiten Energieangebot nur die Energiebeträge
aufnehmen, die den Differenzen zwischen verschiedenen Energieniveaus der
Elektronen entsprechen. Bei der Rückkehr der Elektronen auf energieärmere
Niveaus werden diese Energiebeträge in Form von Licht bestimmter Wellenlänge
emittiert.
Ein Prisma zerlegt das von angeregten Atomen
emittierte Licht in ein für das betreffende Element charakteristisches
Muster von Spektrallinien, das Linienspektrum (Emissionsspektrum), und
erlaubt so die Identifizierung von Elementen (auch in Stoffgemischen):
Spektralanalyse. Angeregte Moleküle liefern Spektren, in denen zahlreiche
Spektrallinien in Gruppen (Banden) dicht beieinander liegen
(Bandenspektren).
(Spektral-)Photometrie
Die Photometrie (Lichtmessung)
untersucht und nutzt im Rahmen der analytischen Chemie die Schwächung eines
Lichtstroms beim Durchtritt durch ein absorbierendes Medium. Unter
Lichtstrom/Intensität versteht man die Lichtenergie, die in der Zeiteinheit
auf eine bestimmte Fläche fällt, die zur Lichtrichtung senkrecht steht.
Bauprinzip des Photometers:
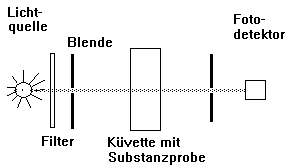
Grundlage
Die Intensität eines
Lichtstrahls nimmt beim Durchlaufen einer
Küvette mit einer Probe (meist einer Lösung) ab. Dieser Verlust an Energie
ist hauptsächlich auf die Lichtabsorption durch die Probe zurückzuführen.
Das Ausmaß der Absorption wird ausgedrückt durch die

Der Absorptionsgrad
a bzw. der Transmissionsgrad
t wird im
Dezimalbruch oder in Prozent ausgedrückt.
Eine Probe, die 90 % der
eingestrahlten Lichtenergie absorbiert (a
= 0,9), lässt 10% der eingestrahlten Lichtenergie durch (t
= 0,1). Absorptionsgrad und Transmissionsgrad ergänzen sich also zu 100 %
a + t =
1
Die Absorption durch eine Lösung
hängt ab
-
von der gelösten Substanz (u.U.
auch vom Lösungsmittel)
-
von der Wellenlänge des
eingestrahlten Lichts
-
von der Anzahl der
absorbierenden Teilchen, auf die das Licht trifft, d. h. von der
Konzentration c der Lösung (c = mol/dm3)
-
von der Weglänge d des
Lichtstrahls in der Lösung (Schichtdicke der Küvette).
Anwendung der Photometrie
Man verwendet dieses Verfahren zur
Konzentrationsermittlung.
Photometrische
Konzentrationsbestimmungen beruhen auf einer gesetzmäßigen Abhängigkeit der
Transmission von der Konzentration des gelösten Stoffes und der Schichtdicke
d der Küvette bei einer bestimmten Wellenlänge des eingestrahlten Lichts
(monochromatische Strahlung). Den Zusammenhang beschreibt das
Lambert-Beersche Gesetz:
Die Lichtintensität nimmt also nach
einer Exponentialfunktion ab. Um einen für die Praxis günstigeren linearen
Zusammenhang zwischen Transmission und der Konzentration bzw. der
Schichtdicke zu erreichen, verwendet man den negativen dekadischen
Logarithmus des Transmissionsgrades t,
die sogenannte Extinktion E:
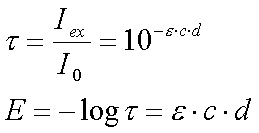
e ist der
dekadische molare Extinktionskoeffizient. Sein Zahlenwert ist
stoffspezifisch und hängt von der eingestrahlten Wellenlänge ab.
In der Praxis arbeitet man in einem
Spektralbereich, in dem das Absorptionsmaximum der betreffenden Substanz
liegt. Dadurch wird die Empfindlichkeit der Messung größer.
Verwendet man bei der
Extinktionsbestimmung Messküvetten mit gleicher Schichtdicke, so ist die
Extinktion der Konzentration der Lösung direkt proportional. Diese
Proportionalität gilt jedoch nur für sehr verdünnte Lösungen (c < 10-2
mol/l). Außerdem dürfen sich die gelösten Substanzen beim Verdünnen nicht
chemisch verändern (Gleichgewichtsverschiebungen).
Ermittlung der Konzentration
einer Substanz
Bei der graphischen Ermittlung
stellt man zunächst eine Eichkurve (Gerade) auf, indem die Extinktionswerte,
die an Lösungen bekannter Konzentrationen ermittelt wurden, in Abhängigkeit
von der Konzentration aufgetragen werden. Anhand dieser Eichgeraden kann
man über die gemessene Extinktion einer Lösung deren unbekannte
Konzentration bestimmen.
Bei der rechnerischen Ermittlung
wird die Extinktion einer Lösung bekannter Konzentration (Standardlösung)
gemessen. Anschließend ermittelt man (mit der Küvette gleicher
Schichtdicke) die Extinktion der Probe unbekannter Konzentration.
Nach der Beziehung:

Massenspektroskopie
Vorteile der
Massenspektroskopie:
hohe Empfindlichkeit (mg-Bereich)
hoher Informationsgehalt
(Molekülmasse, Strukturaufklärung)
Prinzip der Massenspektroskopie
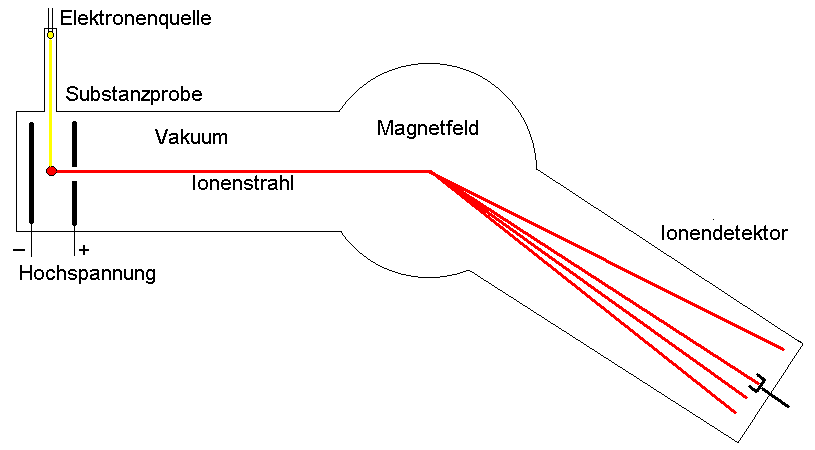
| Ionenerzeugung
meist positiv geladene Ionen, z.B. durch Verdampfen der Probe und
Beschuss mit Elektronen |
Ionenbeschleunigung
durch Potential von einigen 1000 Volt
im Hochvakuum |
Ionenablenkung
meist durch ein homogenes Magnetfeld senkrecht zur Flugbahn (mit
zunehmender Masse wächst der Krümmungsradius) |
Ionennachweis
z.B. Sekundärelektronen- vervielfacher, Ionen- auffänger oder
Photoplatte |
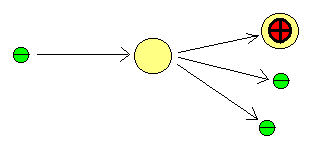
Schema des Ionisierungsvorgangs beim Elektronenstoß: Ein Elektron setzt
durch Stoß mit einem elektrisch neutralen Molekül aus diesem ein weiteres
Elektron frei. Dadurch entsteht ein positives Radialion:
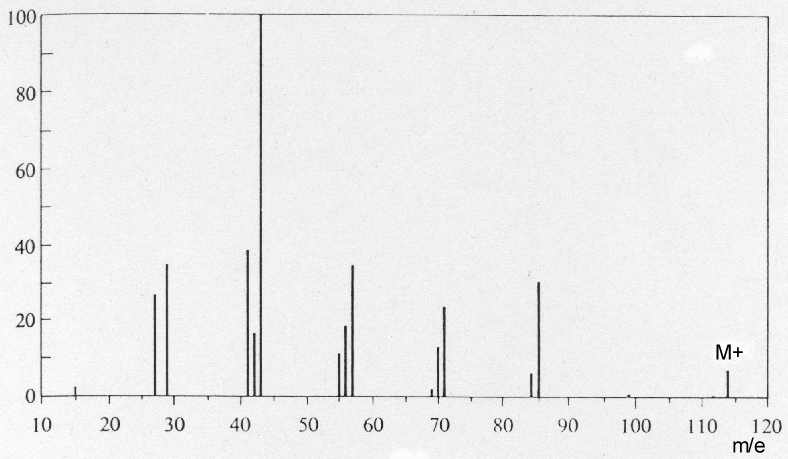
Fragmentierung in Bruchstücke und Umlagerungen
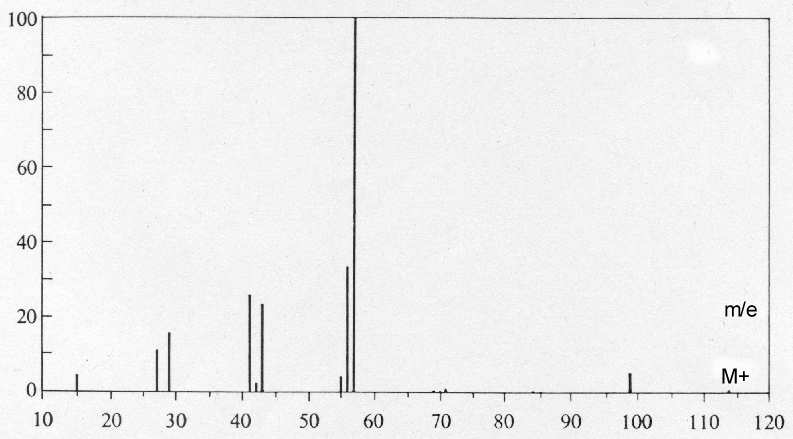
Auswertung der Massenspektren der isomeren Alkane n-Octan und
2.2.4-Trimethylpentan
 |