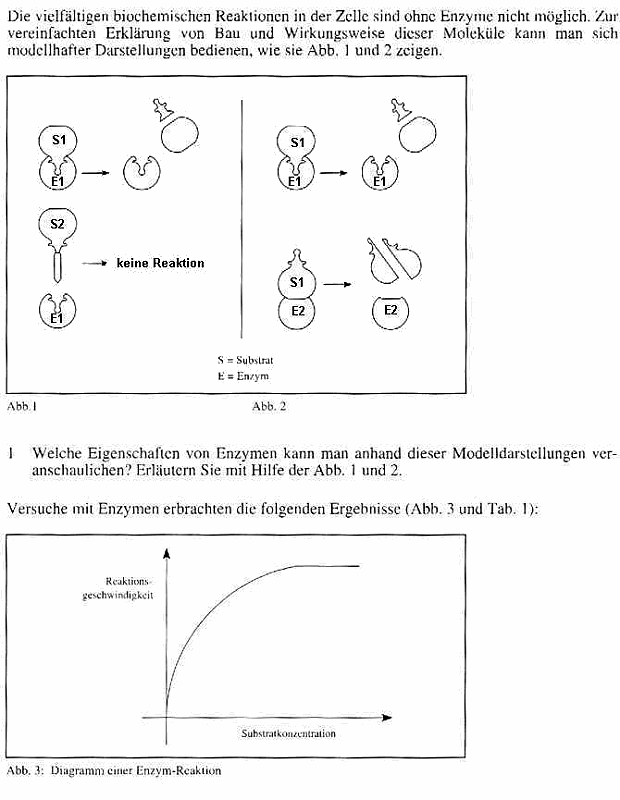
|
Proteine und
Enzyme
1.
Proteinaufbau
Bedeutung der Proteine
-
Transportproteine z.B. Hämoglobin
-
Hormone
z.B. Insulin, Hypophysenhormone
-
Antikörper (Immunglobuline)
-
Strukturproteine z.B. Muskelprotein, Haut ,Sehnen
-
Membranproteine z.B. Tunnelprotein, Rezeptoren
-
Speicherproteine z.B. Milcheiweiß
-
Enzyme
z.B. Azetylcholinesterase
-
Toxine z.B. Bienengift, Schlangengifte
Die Bausteine der Proteinmoleküle:
Aminosäuren
allgemeine Formel einer Aminosäure:
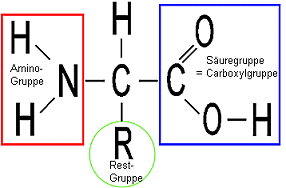
Es
gibt 20 verschiedene Aminosäuren in biologischen Proteinen, d. h. 20
chemisch verschiedene R(este).
7 davon sind essentiell, d.h. sie können
nicht vom Menschen hergestellt werden
--> sie müssen in der Nahrung enthalten sein.
Die Reste können polar (=hydrophil) sein oder unpolar
(=lipophil). Dies ist wichtig für die Funktion des Proteinmoleküls in der
Zelle z.B. die räumliche Form, die Verankerung in Biomembranen, die
Affinität zu anderen chemischen Wirkstoffen (Schlüssel-Schloss-Prinzip)
Die Peptidbindung
Unter Abspaltung von Wasser können sich 2 Aminosäuren
verbinden.
Dabei reagiert die Carboxylgruppe der einen Aminosäure mit der
Aminogruppe der anderen Aminosäure zu einem Dipeptid. Der Bindungstyp
heißt Peptidbindung. Durch Reaktion mit weiteren Aminosäuren
entstehen immer längere Ketten (Tripeptide, .....Polypeptide....ab
100: Proteine)
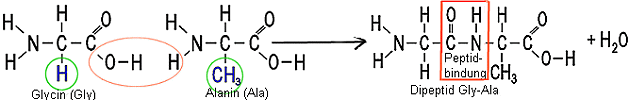
(für Chemiker: Freie Elektronenpaare am O-und
N-Atom sind weggelassen worden)
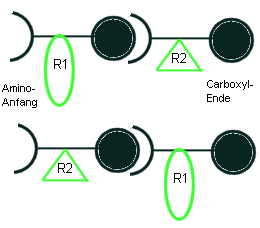
Beachte:
Das Dipeptid Gly-Ala und das Dipeptid Ala-Gly sind
nicht identisch! Da jede Peptidkette einen Amino-"Anfang"
und ein Carboxyl-"Ende" hat, gibt es bei einem Tripeptid
bereits 23=8 Möglichkeiten.
(Benutzte Zahl der verschiedenen Aminosäuren "hoch" die Kettenlänge)
Aufbau der Proteinmoleküle
Proteinmoleküle sind
Riesenmoleküle aus unverzweigten Aminosäureketten.
Sie falten sich
zu übergeordneten Raumstrukturen (= Konformation ).
a) Primärstruktur
Definition: Die Abfolge der Aminosäuren in der Kette =
Aminosäuresequenz
Bindungstyp : Peptidbindung

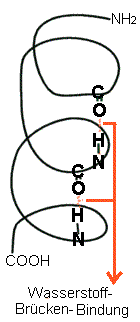
b) Sekundärstruktur
Die
Polypeptidkette liegt nicht gestreckt vor, sondern entweder
in Schraubenform = (a-
Helix) oder als so
genannte
b-
Faltblattstruktur.
Bindungskräfte: Wasserstoffbrückenbindung = "H–Brücken"
(In der
b-Faltblattstruktur werden mehrere
nebeneinander liegende Polypeptidketten durch H–Brücken
zusammengehalten.)
Definition H-Brücke:
elektrostatische Anziehungskräfte zwischen positiv
polarisierten H-Atomen und negativ polarisierten Atomen mit
freien Elektronenpaaren (O, N, )
c) Tertiärstruktur
Die
schraubenförmigen Polypeptidketten liegen ihrerseits in
einer übergeordneten Raumstruktur gefaltet und
„geknäuelt“ vor. Diese Konformation ist abhängig von der
Primärstruktur. Je nachdem, welche Aminosäuren an bestimmten
Kettenpositionen liegen, kommt es zwischen den
Aminosäureresten (R) zu verschiedenen chemisch-
physikalischen Anziehungskräften.
Bindungskräfte:
- H – Brücken (1)
(Dipol-Anziehung/ polare Reste)
- Ionenbindungen (2)
(elektrisch geladene Reste durch zusätzliche Säuregruppe
(-) oder Aminogruppe (+).)
- Van-der-Waals – Kräfte (3)
(unpolare Reste)
- Disulfid – Bindung (4)
"Schwefelbrücke"
(echte Bindung d.h. stärkste Bindungskraft, die die
Raumstruktur stabilisiert.)
--> hitzebeständige Proteine
zeigen einen hohen Cystein-Gehalt!
|
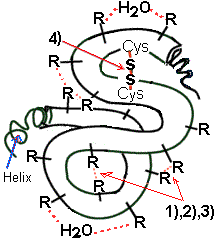
In dieser Raumstruktur sind Proteine biologisch
wirksam als Hormone, Enzyme, Antikörper, etc. Sie falten
sich je nach Aminosäuresequenz selbständig zu ihrer
spezifischen Raumstruktur auf. |
Beispiel:
Insulin (Hormon der Bauchspeicheldrüse)

 d)
Quartärstruktur d)
Quartärstruktur
Mehrere
Polypeptidketten in Tertiärstruktur können sich zusammenschließen,
um eine besondere biologische Funktion zu erfüllen, z.B.
Hämoglobin: vier Polypeptidketten bilden zusammen ein
Transportmolekül für Sauerstoff (roter Blutfarbstoff in den
Erythrozyten)
Ergänzend...:
Problem:
Proteine werden an den Ribosomen
hergestellt.
Ihr Wirkungsort ist aber an den verschiedensten Stellen
innerhalb bzw. außerhalb der Zellen. Woher "weiß" das
Proteinmolekül, wohin es soll? Wie erkennt das Protein seinen
Zielort z.B. "sein" Zellorganell? Wie gelangt es in das von
Membran(en) umgebene Zellorganell hinein?
> Signal-Hypothese
 Der Nobelpreisträger
(1999) Günter Blobel hat entdeckt, dass neu synthetisierte
Proteinmoleküle zusätzlich mit einer "Adresse" versehen
werden, damit sie in der Zelle den Ort finden, wo sie ihre
biologische Wirkung entfalten sollen. Proteine besitzen also so
etwas wie "Postleitzahlen" um sie auf den richtigen Weg zu bringen.
Dies geschieht dadurch, dass am Molekülende eine spezielle
Signalsequenz von 10 bis 30 Aminosäuren angehängt wird. Dieses
Signalpeptid ist dafür zuständig, dass das Protein gezielt
durch die Membranen von Zellorganellen oder an eine bestimmte Stelle
in der Zelle transportiert wird. Der Nobelpreisträger
(1999) Günter Blobel hat entdeckt, dass neu synthetisierte
Proteinmoleküle zusätzlich mit einer "Adresse" versehen
werden, damit sie in der Zelle den Ort finden, wo sie ihre
biologische Wirkung entfalten sollen. Proteine besitzen also so
etwas wie "Postleitzahlen" um sie auf den richtigen Weg zu bringen.
Dies geschieht dadurch, dass am Molekülende eine spezielle
Signalsequenz von 10 bis 30 Aminosäuren angehängt wird. Dieses
Signalpeptid ist dafür zuständig, dass das Protein gezielt
durch die Membranen von Zellorganellen oder an eine bestimmte Stelle
in der Zelle transportiert wird.
Die kurze Peptidkette wirkt als "Schlüssel", die ihr "Schloss"
in Form von spezifischen Rezeptoren auf der Membran des
"Adressaten" findet. Nachdem das Protein so auf der Membran "seines"
Zellorganells angedockt hat, wird eine Reaktionskette in Gang
gesetzt, in deren Verlauf das Protein durch die Membran geschleust
wird.
Man nimmt an, dass dieses Prinzip universal ist, d.h. dass es für
alle Zellen gilt. Fehler bei der "Zustellung" könnten die Ursache
von Krankheiten wie z.B. Mukoviszidose sein.
Chaperone helfen bei der Faltung der Proteine.
Eiweiße (Proteine) sind
langkettige Moleküle, die durch Verknüpfung von Aminosäuren
entstehen. Diese Molekülketten ordnen sich in zunehmend
komplizierter werdenden Formen an. Auf die Primärstruktur
(=Kettenform) folgt durch innermolekulare Kräfte die
Sekundärstruktur: Dabei ergeben sich die Helix- (=Schraube) oder die
Faltblatt-Struktur.
Durch funktionelle Gruppen (z.B. besonders durch die -SH Gruppe
einiger AA) lagern sich wiederum Teile dieser Ketten zusammen. Es
entsteht ein „Knäuel“, die Tertiärstruktur. Während man noch vor
einigen Jahren von einer zufälligen Anordnung sprach, zeigte sich
insbesondere durch die genaue Übereinstimmung der Faltung bei
Enzymen, dass hier für den Zufall kein Platz bleibt.
Für einige Beispiele kennt man
inzwischen sogar „helfende Moleküle“, die die Proteingestalt
zielsicher gestalten: Man spricht von Chaperonen (frz.chaperon, le - die Anstandsdame). Besonders interessant erweist sich
deren Tätigkeit bei der Faltung „gesunder“ in infektiöse Proteine,
wie es bei der Umwandlung von „gesunden“ Prion-Proteinen in
infektiöse Prionen geschieht. Dabei können Chaperone nur tätig
werden, wenn bereits infektiöse Prionen vorliegen.
Übungsaufgaben:
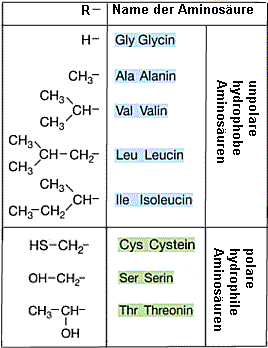 Tabelle: Tabelle:
Einige Aminosäuren mit den zugehörigen Seitenresten
R und deren Polarität |
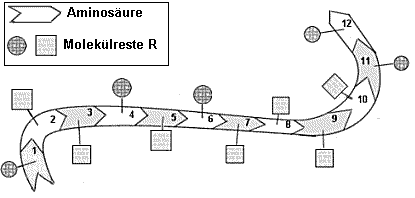 Abb.1: Abb.1:
Ein Polypeptid mit 12 Aminosäuren in Primärstruktur Kreise bzw. Quadrate symbolisieren
polare bzw. unpolare Reste R |
 Abb.2: Abb.2:
Das Polypeptid aus Abb.1 in wässriger Lösung in Raumstruktur |
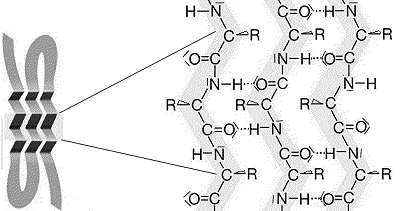 Abb.3:
Ausschnitt aus einem Protein mit beta-Faltblattstruktur Abb.3:
Ausschnitt aus einem Protein mit beta-Faltblattstruktur |
typische Abi-Fragen:
1) Entscheiden Sie, ob die Kreise oder die Quadrate die polaren
Seitenreste symbolisieren.
2) Geben Sie mit Hilfe der Tabelle eine mögliche Aminosäure-Sequenz
für das Polypeptid an, die die Raumstruktur in Abb.2 erklärt.
Begründen Sie ihre Wahl.
3) Durch Mutationen im Erbgut können falsche Aminosäuren in die
Polypeptidkette eingebaut werden.
Welche Mutation hätte für die Raumstruktur -und damit für die
biologische Funktion des Proteins - den größeren Effekt:
a) An Position 10 wird Leucin durch Valin ersetzt
oder:
b) An Position 10 wird Leucin durch Serin ersetzt. Begründen Sie.
4)
Begründen Sie mit der Darstellung in Abb.3, warum Proteine mit
überwiegend beta-Faltblatt-Struktur (Horn, Fingernägel) filzartig
und schlecht wasserlöslich sind. |
| Lösungsvorschläge:
Zu 1) Kreise bedeuten polare
Seitenreste, die die Aminosäure "wasserfreundlich" machen. Sie sind
in Abb. 3 dem Wasser zugewandt. Quadrate bedeuten unpolare
Molekülreste. Sie sind in Abb.3 dem Wasser abgewandt.
zu 2) Die Tertiärstruktur ist die
biologisch wirksame Form eines Proteins. Sie entsteht meist dadurch,
dass sich die Ketten in wässriger Lösung zu einem Knäuel
zusammenfalten. Entscheidend für die Form des Knäuels sind die
Molekülreste der einzelnen Aminosäuren: Hydrophile/polare Reste
versuchen nach außen zu kommen, um mit den umgebenden
Wassermolekülen in Kontakt zu kommen (H-Brücken,
Ionenanziehungskräfte), hydrophobe/unpolare Reste versuchen sich im
"Knäuelinneren" vom Wasser abzugrenzen (Van-der-Waals-Kräfte).
Eine mögliche Aminosäure-Sequenz:
Ser-Ala-Val-Thr-Gly-Cys-Ile-Leu-Val-Ala-Thr-Ser
zu 3) a) Dieser Austausch ändert nichts an der Polarität der
Aminosäure. Die Raumstruktur würde sich also vermutlich nicht
ändern, d.h. das Protein könnte seine biologische Funktion weiterhin
erfüllen.
b) Diese Mutation hätte vermutlich eine große Wirkung auf
die Raumstruktur. Die neue Aminosäure ist polar und würde die Kette
so verdrehen, dass diese Aminosäure nach außen zeigt. Die
biologische Funktion z.B. eine Schlüssel-Schloss-Beziehung z.B. als
Rezeptor oder Signalstoff wäre dadurch blockiert.
zu 4) In der beta-Faltblatt-Struktur
sind die Peptidketten in einer sehr regelmäßigen Struktur
durch innermolekulare H-Brücken verknüpft. Für
Wassermoleküle bleibt kaum mehr übrig, als diese stabilen großen
Molekülkomplexe äußerlich d.h. oberhalb und unterhalb der
Faltblatt-Fläche zu benetzen. |
2.
Enzymeigenschaften
Enzyme sind Biokatalysatoren
Definition
Katalysator:
„Reaktionsbeschleuniger“,
d. h. Stoff, der chemische Reaktionen beschleunigt, indem er ihre
Aktivierungsenergie herabsetzt.
Definition Enzym:
Biokatalysator d.h. Proteinmolekül
mit katalytischer Wirkung
Eigenschaften eines Enzyms:
- Biokatalysator
- Substratspezifität
- Reaktionsspezifität (Wirkungsspezifität)
- Wirkung in kleinsten Konzentrationen
- Hitzeempfindlichkeit
Definition
Substratspezifität:
Ein Enzym kann
nur eine(n) ganz bestimmte(n) Stoff(gruppe)
= Substrat chemisch umsetzen
=>
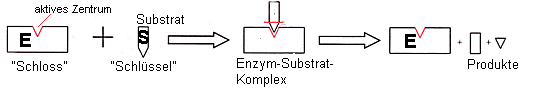
Schlüssel-Schloss-Prinzip
(Schlüssel = Substrat /
Schloss = Aktives Zentrum)
Schema:
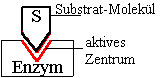
Definition
Reaktionsspezifität:
Ein Enzym kann
sein Substrat nur in einer ganz bestimmten Weise umsetzen,
d.h. nach einem bestimmten Reaktionstyp
z.B. bei Proteinase: Spaltung der
Peptidbindung.
Ein
bestimmtes Enzym1 kann das Substrat nur in P1und P2 spalten; um andere
Spaltprodukte z. B. L1und L2 zu erhalten, braucht man ein anderes Enzym 2,
da eine andere chemische Reaktion abläuft.
Folgerung für eine Zelle:
In einer
Zelle müssen einige hundert verschiedene Enzyme enthalten sein, um alle
Stoffwechselschritte zu katalysieren. Die Zelle kann den Stoffwechsel
dadurch steuern, dass sie die Produktion oder die Aktivität eines Enzyms
kontrolliert (z.B. über Hormone). Ohne Enzym läuft bei Körpertemperatur kaum
eine chemische Reaktion (schnell genug) ab.
Experimente zur
Erklärung der Enzymeigenschaften
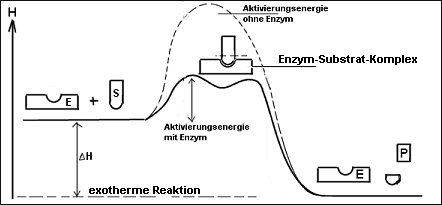
Das
Energiediagramm einer chem. Reaktion mit oder ohne Katalysator.
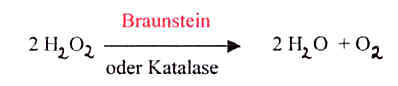
Beispiel -
Spaltung von Wasserstoffperoxid:
Die ätzende farblose
Flüssigkeit zerfällt unter Energiefreisetzung in Wasser und Sauerstoff.
Bei Zimmertemperatur ist die Reaktion jedoch so stark gehemmt, dass keine
O2- Entwicklung nachweisbar ist (Glimmspan-Probe).
Nach Zugabe eines Katalysators (Braunstein) oder des Enzyms Katalase
(in allen Zellen z.B. Blutzellen)läuft die Reaktion spontan ab.
Ergebnis: Es entsteht Sauerstoff und Wasser.
Der Braunstein setzt sich unverändert nach der Reaktion am Rg-Boden ab.
Reaktionsgleichung:
Energiediagramm:
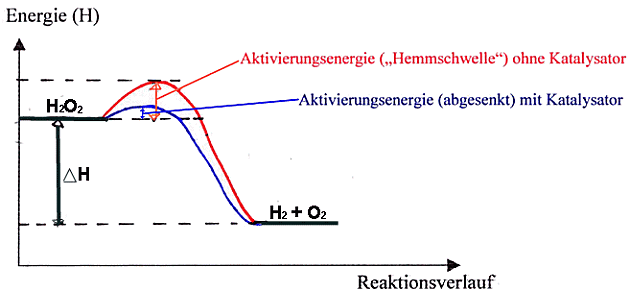
Deutung:
- Braunstein senkt die
Aktivierungsenergie (= “Hemmschwelle“), so dass die Reaktion schon bei
Zimmertemperatur abläuft.
- Der Katalysator nimmt zwar an der
Reaktion teil, wird aber am Ende wieder unverbraucht
freigesetzt à
Wirkung in kleinsten Mengen!
- Der Katalysator ändert nichts am Energieinhalt
der Produkte und Edukte d.h. an der
Reaktionswärme
DH.
Experimente
am Beispiel der Urease:
|
Vorkommen der Urease: |
in
Bakterien, die Harnstoff verwerten (Magenbakterien, Bodenbakterien) |
|
Enzymwirkung: |
Harnstoffspaltung in
Ammoniak und Kohlendioxid |
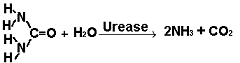 |
|
Chem. Nachweis der Harnstoffspaltung:
|
a) Der entstehende
Ammoniak reagiert mit Wasser zu einer Lauge: Nachweis mit
Indikator (z.B. Phenolphthalein färbt sich rot)
b) die Lauge leitet den elektrischen Strom:
Leitfähigkeitsmessung |
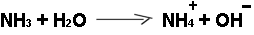 |
|
Experimente: |
- Erhitzen von Harnstoff
- Harnstoffspaltung mit Urease(-lösung)
- Thioharnstoff mit Urease
- Harnstoff(-lösung) + abgekochte Urease
- Harnstoff + Urease + Schwermetall-Ionen
(Cu2+ , Pb2+, Hg2+...)
- Harnstoff + Urease + Enzymgift (z.B.
Formaldehyd)
|
|
Ergebnisse und Deutung: |
zum Experiment 1.
Ohne Enzym kann Harnstoff durch Erhitzen
gespalten werden: Die Aktivierungsenergie wird durch Erhitzen
zugeführt.
zu 2.
Gibt man Urease zur Harnstofflösung, dann erfolgt
die Spaltung schon bei Zimmertemperatur (sofortige Rotfärbung des
Indikators).
Deutung: Urease wirkt
als Katalysator, d. h. als „Reaktionsbeschleuniger“, der
die Aktivierungsenergie so weit herabsetzt, dass die Reaktion schon
bei Zimmertemperatur abläuft.
zu 3.
keine Reaktion
Deutung: Die
Substratspezifität der Urease verhindert, dass der chemisch
ähnliche Thioharnstoff umgesetzt wird. |
Schema:
Substatspezifität"falsches"
Substrat :
Thioharnstoff |
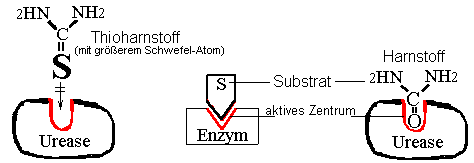 |
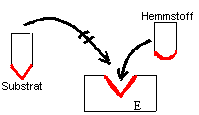
Definition:
kompetitive Hemmung
eines Enzyms: |
Konkurrenz um das aktive Zentrum durch einen chemisch ähnlichen
Stoff führt je nach der Konzentration des "falschen" Substrats zur
teilweisen oder völligen Hemmung des Enzyms. Hier konkurriert der
Hemmstoff mit dem Substratmolekül um das aktive Zentrum.
Die Hemmung ist reversibel und lässt
sich durch Erhöhung der Substratkonzentration rückgängig machen. |
|
Schema: |
|
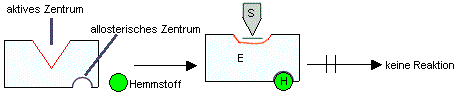
Definition:
allosterische Hemmung
|
Hemmstoffe ohne chemische Ähnlichkeit mit dem Substrat binden
sich an ein so genanntes allosterisches Zentrum, das ist
neben dem aktiven (katalytischen) Zentrum eine weitere
Bindungsstelle. Durch Anlagerung des Hemmstoffs wird das aktive
Zentrum indirekt so verändert, dass das Substrat schlechter
umgesetzt wird.
Durch Erhöhung der
Substratkonzentration kann diese Hemmung nicht aufgehoben werden!
Biologische Bedeutung:
Endprodukthemmung-negative Rückkopplung
Endprodukt E ist für E1 ein
allosterischer Hemmstoff, d.h. bei hoher Konzentration von E
"schaltet sich die Produktion von E von selbst aus."
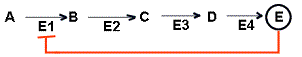 |
|
Schema: |
 |
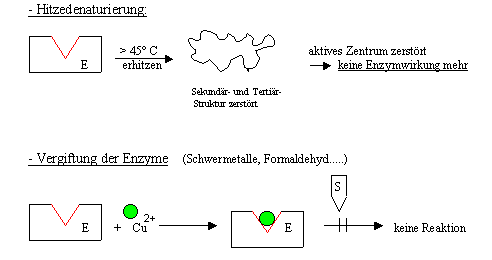
zu
den Experimenten 4., 5. und 6.:
Keine Reaktion: Die Tertiärstruktur und damit das aktive
Zentrum wird in allen Fällen so stark verändert, dass die
Enzymwirkung verloren geht.
zu 4: durch Hitzedenaturierung:
thermische Bewegung durch Erhitzung zerstört die
H-Brücken.
zu 5:
Schwermetallvergiftung:
Schwermetall-Ionen gehen mit best. Aminosäureresten stabile
Bindungen ein
àÄnderung
der Tertiärstruktur
zu 6: Enzymvergiftung: Stoffe,
die mit Proteinen chemisch reagieren, bewirken eine Änderung der
Raumstrukturà
siehe oben |
|
Skizzen: |
 |
Zusammenfassung
- Enzyme sind Biokatalysatoren
- Enzyme gehören chemisch zu den Proteinen
- Enzyme sind substratspezifisch
- Enzyme sind reaktionsspezifisch
- Enzyme wirken in kleinsten Konzentrationen
- Enzyme sind hitzeempfindlich
- Enzyme sind vergiftungsempfindlich
Schematische Darstellung der Enzymwirkung: Der
Enzym-Substrat-Komplex
Allgemeine Enzym-Gleichung:
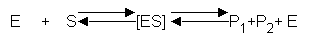
Molekulare
Wirkungsweise eines Enzyms:
Enzyme gehören chemisch
zur Stoffklasse der Proteine. Diese liegen als komplizierte
Raumstruktur - der Tertiärstruktur vor. Die Tertiärstruktur des
Proteins ist an einer bestimmten Stelle, dem aktiven Zentrum,
räumlich so ausgebildet, dass das Molekül des umzusetzenden Stoffes (=Substrat)
genau hineinpasst.
Dieses aktive Zentrum lässt nach dem
Schlüssel-Schloss-Prinzip nur ein bestimmtes Substratmolekül „andocken“.
(-->
Enzym-Substrat-Komplex).
Molekularer Ablauf einer Enzym-Reaktion:
Die Substratmoleküle lagern sich an die Enzymmoleküle
an, in dem sie im aktiven Zentrum andocken. Dadurch werden Bindungen im
Substrat-Molekül gelockert und es kommt zur Absenkung der
Aktivierungsenergie für die Umsetzung des Substrats. Am Ende wird das
Enzym-Molekül wieder unverändert freigesetzt.
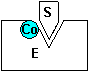
Definition Coenzym
Zusatzstoff, ohne den viele Enzyme nicht funktionieren. Wird
aber, im Gegensatz zum Enzym bei der Reaktion verbraucht, deshalb besser:
Cosubstrat .z.B. ATP, Vitamine..
Enzymbeispiele mit Wirkung und
Vorkommen
|
Name |
Wirkung |
Vorkommen |
|
Urease |
Harnstoffspaltung |
Bodenbakterien, ("Magengeschwür"-Bakterien
Helicobacter pylori) |
|
Katalase |
Spaltung von Peroxiden (H2O2
) |
In allen lebenden Zellen
(z. B. Blutzellen) |
|
Acetylcholinesterase |
Spaltung von Acetylcholin |
Synaptischer Spalt |
Proteinasen:
Pepsin
Trypsin
|
Eiweißspaltung |
Magen
Dünndarm |
|
Amylase
|
Stärkespaltung
|
Speichel, Dünndarm
|
|
DNase |
DNA-Spaltung |
Zellen |
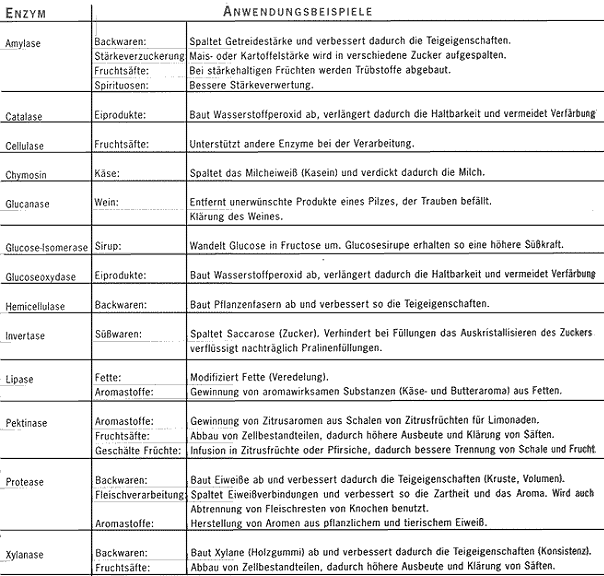
Anwendung der Enzyme in der Technik /
im Alltag
- Biowaschmittel (Proteinasen als
Fleckenentferner)
- in der Lebensmittelchemie
à z.B. Spaltung von Fruchtfleisch für
Säfte
- zur Mürbemachung von Dosenfleisch
- Backhilfsmittel
siehe Tabelle:
3.
Enzymaktivität
Die Abhängigkeit der Enzymaktivität
von verschiedenen Faktoren
Definition Enzymaktivität:
Maß für die Zahl der Substratmoleküle, die ein Enzym pro Sekunde umsetzt
(=Umsatzrate, Wechselzahl)
Definition Reaktionsgeschwindigkeit:
Stoffumsatz pro Zeit d.h. Abnahme des Edukts / Zeit oder Zunahme des
Produkts / Zeit
Faktoren, die die Enzymaktivität
beeinflussen:
1) Temperaturabhängigkeit
2) Die Abhängigkeit von der Substratkonzentration
3) Die Abhängigkeit vom pH-Wert
4) Die Abhängigkeit von Giftstoffen
5) Kompetitive und allosterische Hemmung
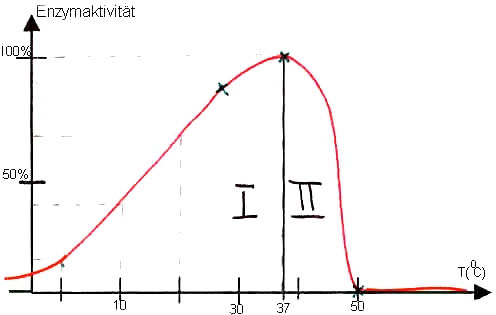
1) Temperaturabhängigkeit
Skizze:
Deutung des
Kurvenverlaufs:
I)
Temperaturerhöhung
bewirkt eine Teilchenbeschleunigung
--> Enzymmoleküle und Substratmoleküle bewegen sich schneller und treffen
häufiger zusammen;
--> die Reaktionsgeschwindigkeit (RG) steigt, d.h. pro Zeiteinheit entsteht
mehr Reaktionsprodukt.
RGT-Regel: Eine Erhöhung
um 10° C bewirkt etwa eine Verdopplung der Reaktionsgeschwindigkeit.
Reaktionsgeschwindigkeits-Temperatur-Regel
II)
Bei einer Temperatur
von ca. 45° C wird die thermische Bewegung der Enzymmoleküle so heftig,
dass die Tertiärstruktur zerstört wird (das bedeutet: H-Brücken,
Disulfid-Brücken .. lösen sich)
--> die RG geht rasch gegen Null, da das aktive Zentrum zerstört wird. -->
Hitzedenaturierung
2)
Abhängigkeit der Enzymaktivität von der Substratkonzentration
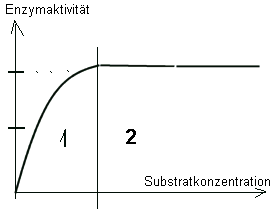 Deutung:
Es handelt sich um eine Sättigungskurve. Deutung:
Es handelt sich um eine Sättigungskurve.
1)
Zunächst
sind noch nicht alle Enzymmoleküle mit Substratmolekülen besetzt
-->
eine Erhöhung
der
Substratkonzentration führt noch zu einer Beschleunigung der Reaktion;
2)
Wenn alle Enzymmoleküle voll „ausgelastet“ sind, kann die RG nicht
weiter steigen. -->
Sättigung!
T=const.
(E)=const.
Wie sähe
die Grafik bei höherer Temperatur aus? Wie sähe die
Grafik bei höherer Enzymkonzentration aus?
3) Die Abhängigkeit vom pH-Wert
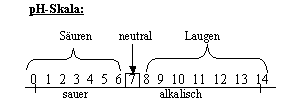 Definition
pH-Wert: Definition
pH-Wert:
Maß dafür, wie stark sauer bzw. alkalisch eine wässrige Lösung ist. (-lg(H3O+))
Skizze:
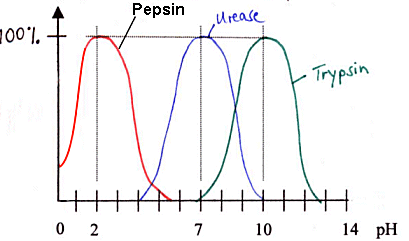 Deutung: Deutung:
Jedes Enzym hat ein pH-Optimumà
Optimumskurven
z.B. Pepsin: Eiweißspaltendes Enzym (Proteinase)
in der Magenflüssigkeit,
die stark sauer ist: pH-Optimum = 2
z.B. Trypsin: Proteinase im Dünndarm
(leicht alkalisch pH-Optimum bei 8 – 10)
z.B. Urease: pH-Optimum = 7
Deutung des Kurvenverlaufs:
Eine pH-Änderung bewirkt eine Änderung der Tertiärstruktur des
Proteinmoleküls.
Grund: Einige Aminosäuren haben in ihrem
Rest zusätzliche Aminogruppen bzw. Carboxylgruppen.
Durch Änderung des pH-Werts ändert sich die Konzentration an H+-Ionen
(H3O+)
-->die Ionenladungen dieser Gruppen ändert sich
-->die Raumstruktur ändert sich.
Nur bei einem bestimmten pH-Wert ist das
aktive Zentrum des Enzyms optimal passend für das Substratmolekül.
4) Die Abhängigkeit von Giftstoffen
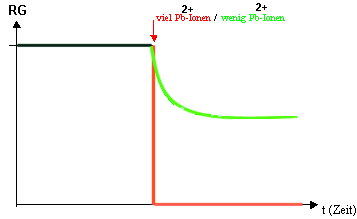 z.
B. die Zugabe von Schwermetall-Ionen zu einer Urease-Reaktion zu einem
bestimmten Zeitpunkt. z.
B. die Zugabe von Schwermetall-Ionen zu einer Urease-Reaktion zu einem
bestimmten Zeitpunkt.
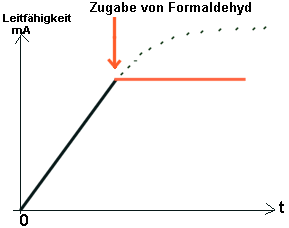 Zugabe
von (nicht leitendem) Formaldehyd Zugabe
von (nicht leitendem) Formaldehyd
Achtung: Hier wird nicht die RG gemessen, sondern die
Menge an entstandenem Produkt! Nach Giftzugabe bleibt die Leitfähigkeit
konstant.
Deutung:
Die
Schwermetall-Ionen bzw. Formaldehyd und andere Gifte binden sich an die
Eiweißmoleküle der Enzyme;
--> Blockierung der
Enzymwirkung durch Veränderung
der Tertiärstruktur
--> RG verringert sich je
nach Giftdosis irreversibel!
5) siehe Enzymeigenschaften
Übungsaufgaben

Lösungsstichworte:
zu 1) Substratspezifität (linke Abbildung) und
Reaktionsspezifität (= Wirkungsspezifität) (rechte Abbildung) +
Erläuterung
zu 2) Abhängigkeit der Enzymaktivität/Reaktionsgeschwindigkeit von der
Substratkonzentration / Sättigungskurve
zu 3) siehe Skript
zu 4) Nein, das pH-Optimum von Pepsin liegt bei 2
d.h. diese Protease arbeitet nur im stark sauren Magen-Milieu.
Entsprechendes gilt für die Dünndarm-Protease Trypsin
Entropie /
Energiekopplung / ATP als Energieüberträger
Die Zelle als offenes System:
Stoff- und Energieaustausch mit der
Umwelt
Kopplung von energieliefernden und
energieverbrauchenden Reaktionen
(Chemische Grundlagen)
Definition
System:
Zusammenwirken vieler Einzelelemente in geordneter Weise, z.B. in
Regelkreisen.

kein Stoffaustausch, kein Energieaustausch
chemisches Gleichgewicht
--> eine Zelle kann kein geschlossenes System sein! |
-->
Lebewesen, Organe und Zellen sind also lebende Systeme.
Definition
Geschlossenes System:
System, das mit seiner Umgebung weder Stoffaustausch noch
Energieaustausch betreibt.
Hier stehen 2 Substanzen A und B durch
eine chemische Reaktion (enzymatisch beschleunigt) in einem stabilen
chemischen Gleichgewicht. (Die Geschwindigkeit der Hinreaktion entspricht
der Geschwindigkeit der Rückreaktion).
Dieses System kann keine Arbeit leisten!
Definition Offenes System:
System gekoppelter Reaktionen, das mit der Umgebung in Stoff- und
Energieaustausch steht.
Hier werden produzierte Substanzen ständig entzogen
("ausgeschieden") und benötigte Substanzen zugeführt.>
Es kann sich kein chemisches Gleichgewicht einstellen > das System kann
dauerhaft Arbeit leisten, da das Erreichen des stabilen chemischen
Gleichgewichtszustandes durch ständigen Zufluss bzw. Abfluss von Substanzen
und Energie (Wärme) verhindert wird (außer im Tode!)
Definition
Fließgleichgewicht (steady state):
Reaktionssystem vieler gekoppelter chemischer Reaktionen
(Reaktionsketten), deren Zwischenprodukte ständig umgesetzt werden - die
aber in konstanten, "stationären" Konzentrationen vorliegen, solange Zu- und
Abfluss (Input / Output) der Substanzen gleich groß sind.
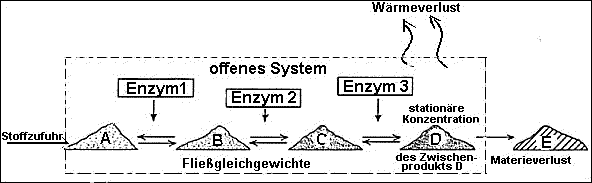
Das offene System kann Arbeit leisten, da keine Zwischenreaktion im
Gleichgewicht ist.
- Das offene System "Zelle" muss in der
Lage sein, auf Störungen der Stoffzufuhr ("Hunger, Durst"), auf
veränderten Bedarf des Endprodukts (z.B. ATP-Mangel bei Anstrengung)
oder Temperaturänderungen zu reagieren. Dies geschieht durch viele
Regelungsvorgänge: z.B. Regelung der Enzymaktivität, Regelung
der Enzymsynthese (Genregulation), Regelung der
Membrandurchlässigkeit, Regelung der Transportvorgänge..
- Die langsamste Zwischenreaktion bestimmt
den "Gesamtdurchfluss" durch das System. Hier liegt die Ursache vieler
Stoffwechselkrankheiten, wenn defekte Enzyme (oder Substrate, Gifte
etc.) die Umsatzrate eines Zwischenprodukts verändern.
Beachte: Die "stationären"
Konzentrationen von Substanzen in Fließgleichgewichten sind oft winzig (-->
Problem bei der Erforschung von Stoffwechselwegen), die Tagesumsätze sind
dagegen groß, da die Zwischenprodukte sofort im Stoffwechsel
weiterverarbeitet werden.
Beispiel ATP-Umsatz: Ein Mensch setzt pro Tag sein eigenes Körpergewicht
an ATP um.
stationäre Konzentration:
ca. 50g -200g ATP pro Mensch mit ca.70 kg Gewicht |
Tagesproduktion an ATP:
In Ruhe: ca.70 kg ATP! (entspricht 8000 kJ/Tag)
Leistungssport: kurzzeitig bis ca. 200 kg ATP! |
|
Umsatzrate (Bakterienzelle): 2.500.000 ATP-Moleküle/sec |
Energetische Grundlagen des Stoffwechsels
Energiegewinnung, Energiespeicherung, Energietransport, Energiekopplung
Definition Energie:
Die Fähigkeit, Arbeit zu leisten.
Gesetzmäßigkeiten, nach denen sich
Stoffwechselvorgänge vollziehen:
1.
Energieerhaltungssatz
Energie kann weder erzeugt noch zerstört
werden, sondern wird nur von einer Form in eine andere Energieform
umgewandelt. (Lichtenergie, Wärmeenergie, chemische Energie, elektrische
Energie, kinetische Energie....)
Zellen können diese Energieformen in verschiedener Form nutzen, um ihren
Stoffwechsel zu betreiben. Letztlich ist die Sonnenenergie der Motor aller
Lebensvorgänge.
siehe Ökologie: Energiefluss in Ökosystemen
2. Das Streben nach einem Minimum an
Energie
Bei jeder chemischen Reaktion kommt
es neben den Stoffumsätzen auch zu Energieumsätzen. Dies beruht darauf, dass
in jeder Substanz ein bestimmter "innerer Energiebetrag" = Enthalpie (=
H) steckt. Diese Energie entspricht z.B. der Energie, die in den
Bindungen (Bindungselektronen) steckt. Bei den chemischen Reaktionen
entstehen neue Stoffe mit neuen Energieinhalten. In der Regel laufen
chemische Reaktion nur dann freiwillig ab, wenn energieärmere Produkte
entstehen. Hier ist die Summe der Enthalpien der Endprodukte niedriger als
die Summe der Enthalpien der Ausgangsstoffe. Die Energiedifferenz wird als
Wärme, Licht, .. freigesetzt. > exotherme Reaktion (DH<0)
Beispiel: Der Abbau von großen
Molekülen mit energiereichen Bindungen in stabilere Kleinmoleküle
(ATP-Spaltung, Glukoseabbau..)
Der Aufbau von biologischen Riesenmolekülen (z.B. Stärke, DNA..) ist nur mit
Aufwand von Stoffwechselenergie möglich, da der Energieinhalt dieser
Moleküle größer ist als die Summe der Energieinhalte der Baustein-Moleküle
(DH>0)
z.B. Um 1mol =180g Glukose aus C02 und H20
herzustellen, sind 2817,7 kJ nötig.
3. Das Streben nach einem Maximum an
Entropie
Eine Zelle ist ein hochgradig geordnetes System von Kompartimenten, in denen
tausende von Substanzen getrennt voneinander auf kleinstem Raum gelagert und
umgesetzt werden. Ohne ständigen Energieaufwand würde durch Diffusion sofort
ein völliges Chaos d.h. eine gleichmäßige Durchmischung aller Stoffe
einsetzen. "Leben" bedeutet also ständigen "Kampf gegen Unordnung". Sofort
nach dem Tod einer Zelle strebt die Entropie einem Maximum zu.
Definition Entropie: Maß für die Unordnung in einem System
Beispiel: Beim Aufbau eines Proteins aus vielen Aminosäurebausteinen
nimmt die Entropie stark ab, da die "Unordnung" der vorher frei beweglichen
Bausteine zugunsten einer geordneten Primär-Sekundär- und Tertiärstruktur
aufgegeben wird. Es ist unwahrscheinlich, dass aus Unordnung spontan Ordnung
entsteht. "Freiwillig" oder "zufällig" würde dieses Molekül also sehr
unwahrscheinlich entstehen.
Ein Lebewesen ist also ein hochgradig geordnetes, entropiearmes System,
das nur durch ständige Energiezufuhr erhalten bleibt!
aus 1 folgt:
Zellen können ihre benötigte Energie in
verschiedenen Formen aufnehmen:
| photoautotrophe
Lebewesen |
Lichtenergie wird
benutzt, um aus energiearmen anorganischen Stoffen (CO2+H2O)
energiereiche organische Stoffe (C6H12O6)
herzustellen
--> Photosynthese |
grüne Pflanzen und
Cyanobakterien
6CO2 +6H2O -->C6H12O6
+ 6O2 |
| chemoautotrophe
Lebewesen |
Chemische Energie aus
oxidierbaren anorganischen Stoffen wird benutzt, um aus
energiearmen anorganischen Stoffen (CO2+H2O)
energiereiche organische Stoffe (C6H12O6)
herzustellen -->
Chemosynthese |
Schwefelbakterien (S2--->S)
Nitratbakterien (NO21--->NO31-)
|
| heterotrophe Lebewesen |
Chemische Energie aus
energiereichen organischen Molekülen (C6H12O6)
wird zur Herstellung eigener energiereicher organischer
Stoffe benutzt -->
Dissimilation (aerob
bzw. anaerob) |
Tiere, Pilze und
Bakterien
aerobe Dissimilation: Atmungsgleichung
C6H12O6 + 6O2-->6CO2
+6H2O
anaerobe Dissimilation: Gärung
C6H12O6-->2C3H6O3
(Milchsäure)
C6H12O6-->2C2H6O
+2CO2 (Ethanol) |
aus 2+3 folgt:
Ob ein Lebensvorgang d.h. eine chemische Reaktion freiwillig abläuft oder
nicht, hängt von der Enthalpie- und Entropie-Bilanz des Vorgangs ab.
Nur freiwillig ablaufende Reaktionen können Stoffwechsel-Arbeit leisten -
man nennt sie exergonische Reaktionen. Wichtige Moleküle des Lebens
(Glukose, Proteine, DNA..) sind sowohl vom Enthalpie- als auch vom
Entropie-Standpunkt aus nur mit Energieaufwand zu erhalten, ihre Synthese
ist ein endergonischer Vorgang. Diese Energie kann nicht wie im
Reagenzglas durch Erhitzen oder elektrische Energie zugeführt werden.
Energetische Kopplung von exergonischen Reaktionen
mit endergonischen Reaktionen - Das ATP/ADP- System
Zellen müssen ständig Arbeit leisten:
- mechanische Arbeit: Kontraktion von
Muskelzellen, Schlagen von Geißeln / Cilien, Verkürzen der Spindelfasern bei
der Chromosomenbewegung...
- Transportarbeit: Ionenpumpen, Herstellung von
Konzentrationsgradienten..
- Chemische Arbeit: Antreiben
energiebedürftiger, endergonischer Aufbau-Reaktionen z.B. Synthese von DNA,
Proteinen..
Soll in der Zelle eine endergonische, d.h.
energiebedürftige chemische Reaktion ablaufen, dann wird diese Reaktion mit
dem fehlenden Energiebetrag dadurch versorgt, dass sie mit einer
exergonischen Reaktion gekoppelt wird (z.B. ATP-Spaltung).
Läuft andererseits eine exergonische Reaktion ab, dann wird die freiwerdende
Energie nicht als Wärme vergeudet, sondern durch energetische Kopplung zur
endergonischen Synthese von ATP genutzt.
ATP = Adenosintriphosphat
ist in Lebewesen die wichtigste "energiereiche Verbindung". ATP ist
ein Molekül, das durch die Art seiner "energiereichen" Bindungen einen
besonders hohen Energieinhalt besitzt: (siehe Formel)
Die 3 Phosphatgruppen stoßen sich durch 4 negative Ladungen auf
engstem Raum stark ab >
die Bindungen - besonders zwischen der letzten
und vorletzten Phosphatgruppe sind besonders energiereich d.h.
instabil und werden unter Energiefreisetzung leicht gespalten (exergonische
R.). Der Rest des Moleküls ist ein Zuckermolekül Ribose und eine
organische Base Adenin.
(Die Bausteine der Nukleinsäuren, die
Nukleotide sind ähnlich gebaut)
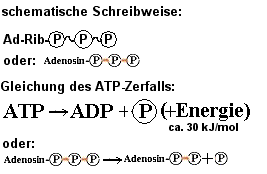

Die Energie, die bei der Spaltung des ATP in ADP (=Adenosindiphosphat)
und Phosphat frei wird, darf aber nicht als Wärmeenergie verpuffen, sondern
muss als chemische Energie für endergonische Reaktionen zur Verfügung
stehen. Dies gelingt durch Kopplung der exergonischen (=Energie
liefernden) mit der endergonischen (=Energie verbrauchenden)
Reaktion.
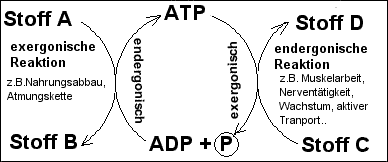 Schema: Schema:
ATP als "chemischer Treibriemen" zwischen exergonischen
und endergonischen
Stoffwechselreaktionen
- ATP als Energiewährung:
Da der ATP-Aufbau auch räumlich und zeitlich
getrennt vom ATP-Abbau ablaufen kann, ist ATP in der Zelle
überall als kurzfristig verfügbare "Energiewährung" im Einsatz.
- ATP als kurzfristiger
Energiespeicher
- ATP als Energietransport-Molekül:
Der Ort der ATP-Synthese muss nicht der Ort der
ATP-Spaltung sein.
|
Beispiele für die Wirkungen des ATP als Energiewährung:
- Aufbau von energiereichen Molekülen: Stärke,
Proteine, DNA., Sehfarbstoff (Rhodopsin)..
- Bewegungsenergie: In Muskelzellen und Geißeln
verändert sich die Raumstruktur von Proteinen.
- Elektrische Energie: Aufbau von Spannungen an
Nervenzellen durch aktiven Transport.
- Wurzeldruck in Pflanzen durch aktiven
Transport.
- Lichtenergie: Biolumineszenz (Glühwürmchen..)
Die Regeneration von ATP: ATP-Zyklus
Eine Muskelzelle setzt ihren gesamten ATP-Vorrat in einer Minute um. Das
bedeutet, dass pro Sekunde und Zelle 10 Millionen ATP-Moleküle verbraucht
aber auch wieder regeneriert werden! Zur Regeneration von ATP durch
Addition von Phosphat an ADP muss der gleiche Energiebetrag aufgewendet
werden, wie beim Zerfall freigesetzt wurde. Deshalb werden alle exergonisch
ablaufenden Abbau-Reaktionen in der Zelle, deren Energiebilanz genügend groß
ist (mind. 30 kJ/mol) zur Regeneration von ATP benutzt. ADP + Phosphat
(+Energie) --> ATPBeispiele für
Vorgänge, die genügend Energie zur ATP-Regeneration liefern:
- Atmungskette: Die Elektronen des Wasserstoffs
werden auf Sauerstoff übertragen
- Glukose-Abbau: Glykolyse z.B. die Oxidation von
Glycerinaldehyd zu Glycerinsäure
- Fettabbau
- Lichtreaktion der Photosynthese
Mechanismus der Energiekopplung bei
Stoffwechselreaktionen:
ATP wirkt als Coenzym/Cosubstrat.
Ein Substrat, das nicht energiereich genug ist, zu einem neuen Stoff weiter
zu reagieren, wird durch Phosphorylierung angeregt, d.h. in einen
höheren Energiezustand versetzt.
--> Das Substrat reagiert - von einem Enzym katalysiert mit dem
Cosubstrat ATP.
Dabei wird ATP gespalten und überträgt seine Phosphatgruppe auf das
Substrat. Das "phosphorylierte" Substratmolekül ist dann so energiereich
geworden, dass es in einer Folgereaktion (von einem zweiten Enzym
katalysiert) exergonisch weiterreagiert.
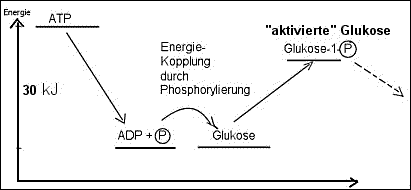
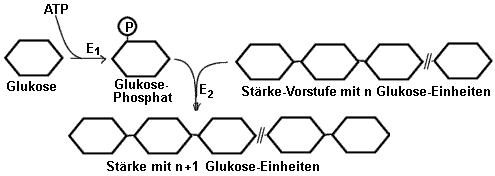
Beispiel: Die Phosphorylierung der Glukose bei der Stärkesynthese:
Der Aufbau von Stärke aus Glukosemolekülen ist eine endergonische Reaktion
und läuft nur unter ständiger Energiezufuhr ab. Durch Phosphorylierung
werden die Glukose-Moleküle so energiereich, dass ihre Verknüpfung zu langen
Polysaccharid-Ketten nun freiwillig , d.h. energetisch "bergab" abläuft.
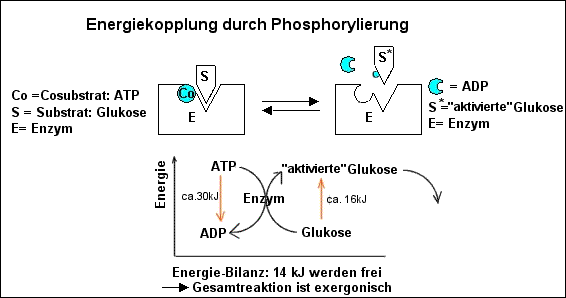
Schema: ATP als Phosphatgruppen-Donator
Zusammenfassung: Energiehaushalt
- Glukose ist der Rohstoff, der in
allen Lebewesen für den Energiestoffwechsel benötigt
wird. (Speicherform: Stärke (Pflanzen), Glykogen (Tiere)
- Glukose wird von autotrophen
Lebewesen selbst hergestellt, heterotrophe Lebewesen sind
auf die Zufuhr von außen angewiesen.
- Zur Energiegewinnung setzen die
Organismen die Glukose entweder mit Sauerstoff in CO2
und Wasser um (Biologische Oxidation, Aerobe Dissimilation,
Zellatmung, innere Atmung), oder ohne Sauerstoff
(anaerobe Dissimilation, Gärung). (Auch Pflanzen
atmen bei Tag und Nacht!)
- Die freiwerdende chemische Energie wird
in allen Lebewesen im ATP/ADP-System gespeichert. ATP ist
der universelle, transportable Kurzzeitspeicher für Energie
in den Zellen.
- Durch Energiekopplung entsteht ATP
bei exergonischen Reaktionen (z.B. bei biologischen Oxidationen)
und zerfällt wieder in ADP und Phosphat bei Kopplung mit
energiebedürftigen (endergonischen) Prozessen in den Zellen.
|
Aufgaben:
1)
2)
Erläutern Sie an nebenstehendem Schema
a) die Bedeutung der grünen Pflanzen für den Energiehaushalt in den
Ökosystemen.
b) Die chemischen Grundstoffe werden in Ökosystemen ständig wiederverwertet.
Für die Energie gilt dies nicht. Begründung!
3) Warum gibt es kein
ATP-Doping durch Essen oder Spritzen von ATP vor Wettkämpfen?
4)
Das Gehirn braucht täglich ca.100g Glukose zur
Energieversorgung. Beim oxidativen Abbau der Glukose wird als
Energieausbeute ca. 48% in Form von ATP gespeichert.
a) Wo bleibt die Restenergie, die beim Glukoseabbau frei wird?
b) Berechnen Sie, wie viel Gramm ATP pro Tag im Gehirn umgesetzt werden.
(1 mol Glukose = 180g;1mol ATP = 500g; 1mol Glukose liefert in der aeroben
Dissimilation 38mol ATP.)
5) Der
Gesamtenergieumsatz eines ruhenden Menschen beträgt ca.10 000 kJ (ca. 2500
"Kalorien") pro Tag.
Das Nervensystem benötigt davon bei nur 2% der Körpermasse 20% des
Gesamtenergieumsatzes pro Tag!
a) Berechnen Sie, wie viel Gramm ATP ein Mensch pro Tag umgesetzt und
b) wie viel davon dem Nervensystem zukommt. (Gesamtenergieumsatz pro Tag:
10 000 kJ, davon werden 48% in Form von ATP gespeichert; Energiespeicherung
pro 1mol ATP: ca. 30 kJ/mol; 1 mol ATP =500g.)
6)
Die Energieausbeute pro Mol Glukose beträgt bei Abbau mit Sauerstoff
(Atmung): 38 mol ATP d.h. ca. 6.3 kJ pro g Glukose
Die Energieausbeute pro Mol Glukose beträgt bei Abbau ohne Sauerstoff
(Gärung) 2 mol ATP d.h. ca. 0,33 kJ pro g Glukose
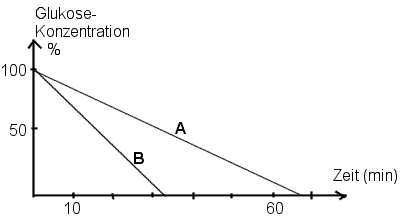
Hefezellen können Glukose je nach Sauerstoffbedingungen "veratmen" oder
"vergären". Das folgende Diagramm zeigt den Verlauf der Glukosekonzentration
unter Atmungs- bzw. unter Gärungsbedingungen. Vergleichen Sie den Verlauf
der beiden Kurven A und B und ordnen Sie A und B begründend
der Atmung bzw. Gärung zu.
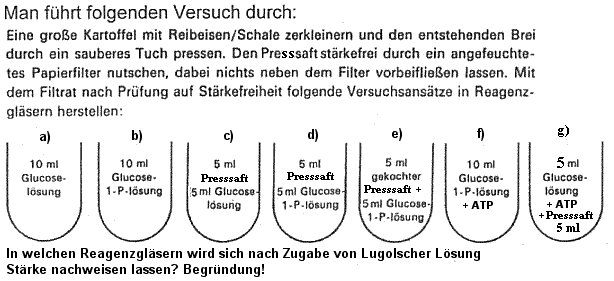
Lösungsvorschlag
zu 1a): keine Stärke, da keine Enzyme und
keine Aktivierung der Glukose durch Phosphorylierung.
b: keine Stärke, da keine Enzyme
c: keine Stärke, da keine Aktivierung der Glukose durch
Phosphorylierung.
d: Stärkenachweis durch Blaufärbung mit Lugolscher Lösung
e: keine Stärke, da Enzym durch Kochen denaturiert sind.
f: keine Stärke, da keine Enzyme
g: Stärkenachweis, falls alle Enzyme vorhanden sind.
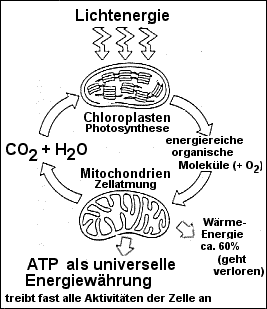
zu 2a) Nur grüne Pflanzen können Lichtenergie
in Form von chemischer Energie speichern. Die Photosynthese liefert den
Pflanzen selbst und allen heterotrophen Lebewesen die energiereichen
organischen Moleküle. Diese werden dann mit O2 (=Atmung) oder
ohne O2 (=Gärung) zwecks ATP-Gewinnung abgebaut. Das dabei
entstehende CO2 ist sogar wieder Rohstoff der Photosynthese.
zu 2b) Nur ein Teil der chemischen Energie,
die in den organischen Molekülen steckt kann in Form von ATP gespeichert
werden. Der größte Teil geht als Wärmeenergie verloren.
zu 3)
- sehr kurze biologische Halbwertszeit
- durch Rückkopplung würde die körpereigene ATP-Synthese gehemmt werden >
nachfolgender ATP-Mangel
zu 4a) Wärmeenergie
zu 4b):
100g Glukose entsprechen 100/180 = 5/9 = 0,56 mol Glukose. In der aeroben
Dissimilation ergibt das 0,56 x 38= 21,28 mol ATPà21,28
x 500g = 10640Gramm = 10,64 kg
zu 5a) 48% von 10 000kJ sind 4800kJ, die als ATP gespeichert werden.
à
das sind 4800/30 = 160 mol ATP à
das entspricht 160 x 500g =
80.000g = 80 kg ATP!
zu 5b) 16 kg
zu 6) Der Glukoseverbrauch ist bei der Gärung
viel höher, da die Energieausbeute pro Glukosemolekül 19 mal geringer ist.>
Die Kurve B entspricht der Gärung, der Glukoseverbrauch ist pro Zeiteinheit
größer d.h. der Glukosevorrat geht viel schneller zur Neige.
Proteine als
Membranbausteine
wird im Moment überarbeitet
Quelle eines Großteils dieses Scripts:
Scheffel-Gymnasium Lahr
Verbessere dieses Script weiter! und maile es an
oberstufe@klassenarbeiten.de
|


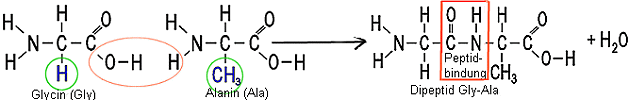





 d)
Quartärstruktur
d)
Quartärstruktur Der Nobelpreisträger
(1999) Günter Blobel hat entdeckt, dass neu synthetisierte
Proteinmoleküle zusätzlich mit einer "Adresse" versehen
werden, damit sie in der Zelle den Ort finden, wo sie ihre
biologische Wirkung entfalten sollen. Proteine besitzen also so
etwas wie "Postleitzahlen" um sie auf den richtigen Weg zu bringen.
Dies geschieht dadurch, dass am Molekülende eine spezielle
Signalsequenz von 10 bis 30 Aminosäuren angehängt wird. Dieses
Signalpeptid ist dafür zuständig, dass das Protein gezielt
durch die Membranen von Zellorganellen oder an eine bestimmte Stelle
in der Zelle transportiert wird.
Der Nobelpreisträger
(1999) Günter Blobel hat entdeckt, dass neu synthetisierte
Proteinmoleküle zusätzlich mit einer "Adresse" versehen
werden, damit sie in der Zelle den Ort finden, wo sie ihre
biologische Wirkung entfalten sollen. Proteine besitzen also so
etwas wie "Postleitzahlen" um sie auf den richtigen Weg zu bringen.
Dies geschieht dadurch, dass am Molekülende eine spezielle
Signalsequenz von 10 bis 30 Aminosäuren angehängt wird. Dieses
Signalpeptid ist dafür zuständig, dass das Protein gezielt
durch die Membranen von Zellorganellen oder an eine bestimmte Stelle
in der Zelle transportiert wird.  Tabelle:
Tabelle: Abb.1:
Abb.1:  Abb.2:
Abb.2:  Abb.3:
Ausschnitt aus einem Protein mit beta-Faltblattstruktur
Abb.3:
Ausschnitt aus einem Protein mit beta-Faltblattstruktur



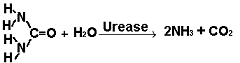


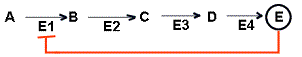









 Deutung:
Deutung:







 Schema:
Schema:




