|
Prüfungsfragen: Anilin und
seine Reaktionen
Anilin kann durch Reduktion von Nitrobenzol erhalten werden.
a) Wie kann am Benzolring die Nitrogruppe
eingeführt werden?
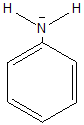
b) Nennen Sie die wichtigsten Eigenschaften von
Anilin.
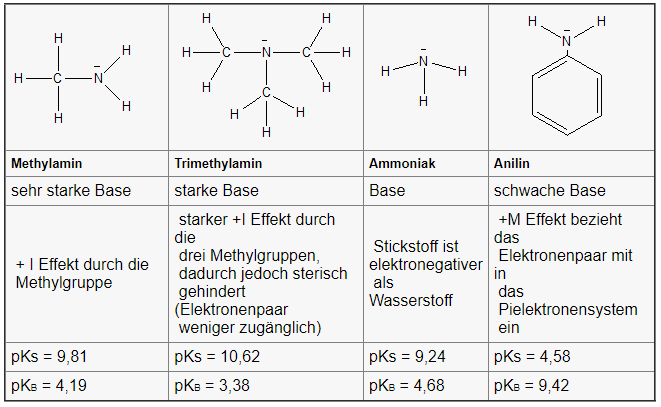
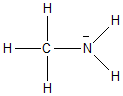
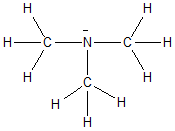
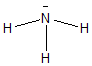
c) Vergleichen sie Ammoniak, Anilin, Methylamin und
Trimethylamin hinsichtlich ihrer
Basizität. Begründen Sie die unterschiedliche Basenstärke.
d) Wie und unter welcher Bedingung lässt sich
Ammoniak bromieren?
Welches Produkt entsteht dabei?
Lösung: Anilin und seine
Reaktionen
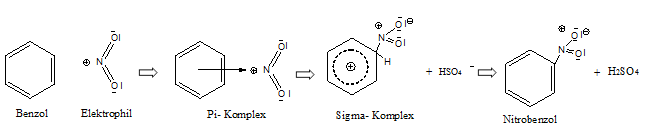
a) Die Einführung der
Nitrogruppe in den Benzolring erfolgt durch die Nitrierung
von Benzol:
Die Nitrierung von Benzol ist eine
elektrophile Substitutionsreaktion. Das zur Reaktion
benötigte elektrophile Teilchen
entsteht bei der Umsetzung von Schwefelsäure mit
Salpetersäure zu Nitriersäure.
Ein elektrophiles Teilchen ist
positiv geladen und zieht Elektronen an.
HNO3
+ H2SO4
 NO2+ + HSO4-
+ H2O
NO2+ + HSO4-
+ H2O
Schwefelsäure
Salpetersäure
Nitriersäure
Wasser
Das elektrophile
Teilchen ist in diesem Fall das Nitroniumion (NO2+ -Ion).
Die Nitrierung von Benzol erfolgt nun
durch die Annäherung eines Nitroniumions an ein
Benzolmolekül.
 |
b)
Eigenschaften von Anilin:
- farblose,
leicht ölige Flüssigkeit.
Die Flüssigkeit ist leicht ölig, da sich vereinzelt
Wasserstoffbrückenbindungen zwischen den Aminogruppen
aufbauen können. Weitere Anziehungskräfte sind die
Van- der- Waalskräfte zwischen den unpolaren Benzolringen
und Dipolkräfte. Diese resultieren an der stärkeren
Elektronegativität des Stickstoffatoms im Vergleich zu den
Wasserstoffatomen.
-
reagiert mit Wasser leicht basisch.
Grund dafür ist das freie Elektronenpaar an welches sich ein weiteres
Wasserstoffion (Proton) anlagern kann. Allerdings ist die Basizität des
Anilin gering, da das freie Elektronenpaar in das Pielektronensystem des
Benzolrings mit einbezogen wird (+M- Effekt).
-
Bildet mit starken Säuren wasserlösliche Salze.
-
cancergen (krebserregend)
Anilin wird über die Haut aufgenommen und oxidiert den roten
Blutfarbstoff.
Dadurch wird die Sauerstoffaufnahme und der Sauerstofftransport
im Blut vermindert oder schlimmstenfalls blockiert.
-
umweltschädigend
Anilin ist durch seine oxidierende Wirkung sowie sein
leicht basisches
Verhalten umweltschädigend und sollte den Sicherheitsbestimmungen
gemäß gehandhabt werden
c) Begründung der
unterschiedlichen Basenstärke aufgrund der Strukturformel:
Die
Basizität eines Stoffes hängt von der Verfügbarkeit des ungebundenen
Elektronenpaars (in diesem Fall am
Stickstoffatom) ab.
Je höher die Elektronendichte am
Stickstoffatom ist (beispielsweise durch +I Effekt
oder Elektronegativitätsdifferenzen),
desto leichter lagert sich bei der Protolyse ein
Proton an das freie Elektronenpaar
an, d.h. desto basischer oder alkalischer reagiert
der Stoff.
 |
 |
 |
 |
| Methylamin |
Trimethylamin
|
Ammoniak
|
Anilin
|
| sehr starke Base |
starke Base |
Base |
schwache Base |
+ I Effekt durch die
Methylgruppe |
starker +I Effekt durch die
drei Methylgruppen,
dadurch jedoch sterisch
gehindert (Elektronenpaar
weniger zugänglich) |
Stickstoff ist elektronegativer
als Wasserstoff |
+M Effekt bezieht das
Elektronenpaar mit in
das
Pielektronensystem
ein |
| pKs = 9,81 |
pKs = 10,62 |
pKs = 9,24 |
pKs = 4,58 |
| pKB =
4,19 |
pKB =
3,38 |
pKB = 4,68 |
pKB =
9,42 |
Man kann ebenso über die pKs oder pKB Werte argumentieren. Diese
werden aus
der jeweiligen
Tabelle entnommen. Der pKB Wert errechnet sich aus
dem pKs Wert
folgendermaßen (pKw
beträgt immer 14):
pKw - pKs = pKB
also 14 - pKs = pKB
Je kleiner der
Zahlenwert des pKs bzw. pKB Wertes ist, desto
stärker ist die Säure
bzw. Base.
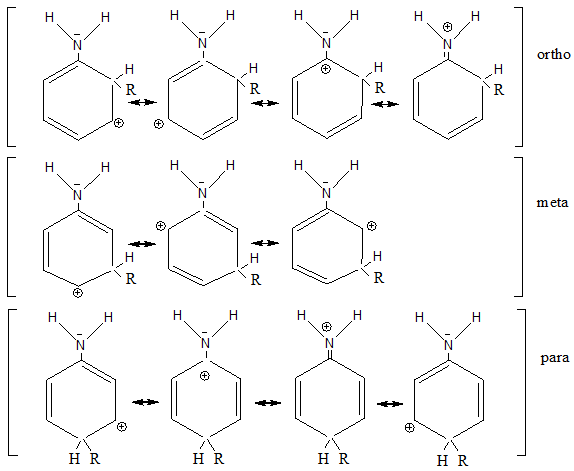
d) Die Bromierung von Anilin:
Anilin besitzt
einen +M Effekt (das freie Elektronenpaar wird in den Benzolring mit
einbezogen) sowie einen -I Effekt
(das Elektronegative Stickstoffatom zieht
Elektronen aus dem Ringsystem an
sich).
In diesem Fall gilt:
-I > +M
der -I Effekt überwiegt. Dadurch lässt sich bereits vermuten, dass der
vorhandene Substituent am Benzolring (in diesem Fall die
Nitrogruppe) in Ortho- und Parastellung dirigiert.
Nachweis über die Mesomeren Grenzformeln:
| Mesomere Grenzformeln des Anilins |
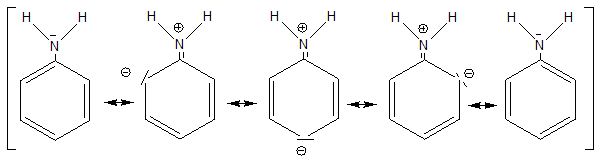 |
Zweitsubstitution am Anilin
Ob Ortho,
Metha oder Parastellung bei der Zweitsubstitution überwiegen erkennt man
an
den Mesomeren Grenzstrukturen der Sigmaform
des Moleküls.
Je mehr mesomere Grenzstrukturen ein
Molekül besitzt, desto stabiler ist es.
Zur Bromierung von Anilin
kann außerdem ein Katalysator verwendet werden. Dieser
setzt die Aktivierungsenergie der
Reaktion herab, liegt aber am Ende der Reaktion
wieder unverändert vor.
|